
【题目】现有中学化学常见三种金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙______________、H______________。
(2)写出反应⑤的离子方程式:__________________________________________。
(3)D溶液与F溶液反应,生成沉淀,该沉淀的化学式为_____________,该沉淀在空气中由白色很快变为灰绿色最后变为红褐色,该反应的化学方程式为______________。
(4)物质C与物质E的溶液反应生成5.6 L氢气(标准状况)时,参与反应的物质C的质量是_______克。
【答案】 Cl2 Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 14
【解析】金属单质A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3.
(1)气体乙的化学式:Cl2,H为Fe(OH)3;
(2)反应⑤的离子方程式为Fe2++Cl2=2Fe3++2Cl-;
(3)物质D与物质F的溶液反应生成沉淀的化学式为Fe(OH)2,该沉淀在空气中从白色很快变为灰绿色最后变为红褐色,该反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)Fe与稀盐酸生成5.6 L氢气(标准状况),氢气的物质的量为0.25mol,则Fe的物质的量为0.25mol,质量为56g/mol×0.25mol=14g。


科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
A. B的转化率为20%
B. 平衡时A的浓度为1.50mol/L
C. x=1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO | 稀硫酸 | 3Fe 2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-= Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3OH-= Al(OH)3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是 ( )
A.普通硅酸盐陶瓷 B.氮化硅陶瓷 C.光导纤维 D.玻璃钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组指定物质的结构种数相等的是
A. 乙烷的二氯代物和丙烷的一氯代物
B. 丙烷的一氯代物和戊烷
C. 苯的二氯代物和苯的一硝基取代物
D. C3H5Br3和C5H11Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3﹣Na2O,O2﹣可以在其中自由移动.
下列有关叙述正确的是( )

A. 电极a的反应式为:CH4+4O2﹣﹣8e﹣=CO2+2H2O
B. 电极b是正极,O2﹣由电极a流向电极b
C. 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b
D. 当固体电解质中有2 mol O2﹣通过时,外电路通过电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性的透明溶液中可能含有下列微粒中的几种。
阴离子:MnO4-、SiO32-、CO32-、I-、ClO-、SO32-
阳离子:Fe3+、Fe2+、NH4+、Ag+、Al3+、K+
分子: H2SO3
取该溶液进行以下连续实验。
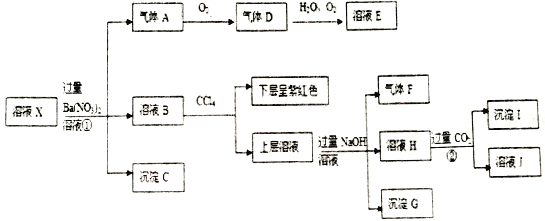
根据以上信息,回答下列问题:
(1)根据“强酸性的透明溶液”可知溶液中不含有的微粒是__________________;
(2)沉淀I的化学式为_____________;
(3)X溶液中,除H+、Al3+外还肯定含有的微粒是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com