
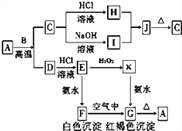
【题目】A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
按要求写方程式:
(1)A与B在高温条件下生成C和D的化学方程式:_______
(2)F在空气中转化为G的化学方程式: _________________________。
(3)C转化为I的离子方程式: _________。
(4)E转化为K的离子方程式: _________。
【答案】 Fe2O3+2A1![]() A12O3+2Fe 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2A1O2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O
A12O3+2Fe 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2A1O2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】A是一种红棕色金属氧化物,A是氧化铁。B、D是常见金属单质,B与A在高温下反应生成C和D,所以该反应是铝热反应,则B是Al,C是氧化铝,D是Fe。氧化铝与盐酸反应生成H是氯化铝,与氢氧化钠溶液反应生成I是偏铝酸钠,二者反应生成J是一种难溶于水的白色化合物,受热后容易发生分解,J是氢氧化铝,分解生成氧化铝。铁与盐酸反应生成E是氯化亚铁,氯化亚铁与双氧水反应生成K是氯化铁,氯化铁与氨水反应生成G是氢氧化铁,氯化亚铁与氨水反应生成F是氢氧化亚铁,氢氧化亚铁氧化生成氢氧化铁,氢氧化铁分解生成氧化铁。则根据以上分析可知
(1)A与B在高温条件下生成C和D的化学方程式为Fe2O3+2A1![]() A12O3+2Fe;(2)F在空气中转化为G的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)C转化为I的离子方程式为Al2O3+2OH-=2A1O2-+H2O。(4)E转化为K的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
A12O3+2Fe;(2)F在空气中转化为G的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)C转化为I的离子方程式为Al2O3+2OH-=2A1O2-+H2O。(4)E转化为K的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。请回答下列问题。
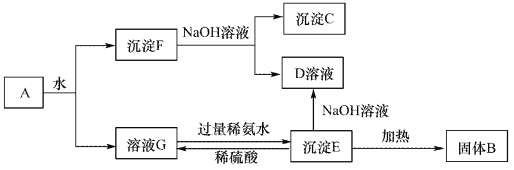
(1)沉淀F与NaOH溶液反应的离了方程式为_______________。
(2)沉淀C与稀硫酸反应的离子方程式为_______________。
(3)溶液G与过量稀氨水反应的化学方程式为_______________。
【答案】 Al2O3 + 2 OH-=AlO2-+H2O Fe2O3 + 6H+ =2 Fe3++3H2O Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4
【解析】根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;
将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,硫酸铝和氨水反应生成Al(OH)3和硫酸铵,(1)沉淀F与NaOH溶液反应的离子方程式为:Al2O3 + 2 OH-=AlO2-+H2O;(2)沉淀C为Fe2O3,Fe2O3与稀硫酸反应的离子方程式为:Fe2O3 + 6H+ =2 Fe3++3H2O;(3)溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4。
点睛:本题考查了常见物质的分离与提纯方法综合应用,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质,A溶于水得沉淀F和溶液G,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G为硫酸铝溶液,沉淀F为氧化铝和氧化铁;将沉淀F溶于过量氢氧化钠溶液中,氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2溶液,溶液G中加入过量的氨水得到沉淀E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,据此进行解答。
【题型】综合题
【结束】
27
【题目】图中是实验室制备SO2并验证SO2某些性质的装置图。试回答:
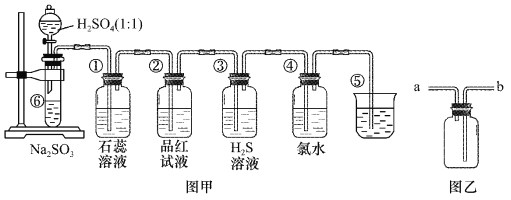
(1)如果用浓硫酸和铜来制取SO2,发生装置还需选用的仪器是________,化学方程式为_________ 。
(2)⑤的作用是________,反应的离子方程式为________ 。
(3)选用图乙收集SO2气体,气体从________ 口 进。
(4)填表格
装置 | 实验现象 | 体现SO2的性质 |
① | ____________ | ____________ |
② | ____________ | ____________ |
③ | ____________ | ____________ |
④ | ____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物遇硝酸银溶液产生白色沉淀
D.该有机物在一定条件下能发生消去反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化: 1molA(分子式C8H16),氧化得到2mol酮D.
(R、R′、R″是各种烃基)如上式烯烃的氧化反应,双键被高锰酸钾酸性溶液氧化而断裂,在断键两端的碳原子都被氧化成为羧基或酮羰基.由氧化所得的产物,可以推测反应物烯烃的结构.今有A、B、C三个含有双键的化合物,它们被上述溶液氧化: 1molA(分子式C8H16),氧化得到2mol酮D.
1molB(分子式C8H14),氧化得到2mol酮E和1mol二元羧酸.
1molC(分子式C8H14),氧化只得到一种产物,它是一种没有支链的二元羧酸.
请据此推断B、C、D、E的结构简式为:B、C、D、E .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同温同压下,据有相同数目分子的气体必具有相同的体积
B.等质量的O2和H2的物质的量之比为16∶1
C.不同的气体若体积不等,则它们所含的分子数一定不等
D.同温同体积下,两种气体的物质的量之比等于压强之反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.17g氨气所含电子数目为10NA
B.32g氧气所含原子数目为NA
C.在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.32g氧气与44g二氧化碳的体积一定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com