
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氰化亚铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。
假设2:红色粉末是Cu2O。
假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含二氰化二铁。你认为这种说法合
理吗? 。简述你的理由(不需写出反应的化学方程式): 。
(3)若同体粉末完伞溶解尢同体存在.滴加KSCN试剂时溶液不变红色.则证明原同体粉末是 ,写出发生的氧化还原反应的离子方程式: 。
【探究延伸】
(4)绎实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。纤杏阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:

实验小组设汁如下实验方案:

①试剂1为 .试剂2为 . (填字母)
A.氯水 B.H2O2 C.NaOH
②同体X的化学式为 。
③操作II为 。
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中,能大量共存的离子组是( )
A. Na+、NO3-、Mg2+、Cl- B. Na+、CO32-、K+、NO3-
C. Cu2+、K+、SO42-、Cl- D. Ba2+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+ C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁一过氧化氢燃料电池具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4 MgSO4+2H2O,结构示意图如图所示。下列关于该电池的叙述正确的是
A.电池内部可以使用MnO2作填料
B.电流工作时,H+向Mg电极移动
C电池工作时,正极的电板反应式为Mg—2e— Mg2+
D.电池工作时,电解质溶液的pH将不断变大
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如右下图所示,下列说法一定正确的是
A.最高价氧化物对应水化物的酸性最强的是W
B.Y与Z只能形成一种化合物
C.简单阴离子还原性:Y>W
D.Z与Q形成的化合物水溶液可能显酸性
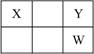
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
a.Ba(NO3)2 b.BaCl2 c.Ba(OH)2 d.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
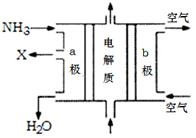 (3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;
②SiO2;③碘;④金刚石;⑤NaCl;⑥白磷,其中含有两种作用力的组合是( )
A.①②⑤ B.①③⑥ C.②④⑥ D.①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是( )
①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A.①② B.③④ C.②③ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com