
[化学一一选修化学与技术](15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
(1)硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:
,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰 kg。
(2)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是 。
|
①图中a表示 离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示 ,E表示 。
②阳极的电极反应式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
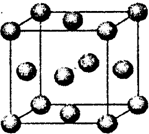 (2011?丹东模拟) 化学一一选修物质结构与性质
(2011?丹东模拟) 化学一一选修物质结构与性质| Mr | ||
4
|
| Mr | ||
4
|
查看答案和解析>>
科目:高中化学 来源: 题型:
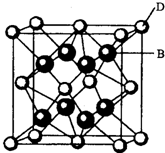 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2010届高三下学期双基测试卷(化学) 题型:填空题
[化学一一选修化学与技术](15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
(1)硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:
,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰 kg。
(2)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是 。
|
①图中a表示 离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示 ,E表示 。
②阳极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com