
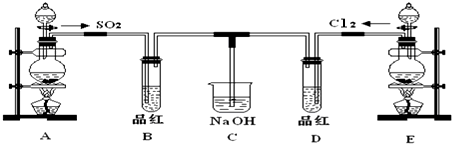
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.分析 (1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,强酸制取弱酸;
(2)①二氧化硫和水反应生成亚硫酸,紫色石蕊试液遇酸变红色;二氧化硫有漂白性,但不能使石蕊褪色;
②二氧化硫有还原性,氯气有强氧化性,所以二氧化硫和氯气能发生氧化还原反应生成硫酸和氯化氢,氯水的淡黄绿色褪去;
③二氧化硫和二氧化碳有相似性,都能使澄清的石灰水变浑浊,继续通入二氧化硫,二氧化硫和亚硫酸钙反应生成可溶性的亚硫酸氢钙;
④二氧化硫有还原性,双氧水有强氧化性,所以二氧化硫和双氧水能发生氧化还原反应生成硫酸;碳酸盐和碳酸氢盐能与硫酸反应生成二氧化碳;
解答 解:(1)亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)①二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性,紫色石蕊试液遇酸变红色,所以溶液会变红,
故答案为:变红;
②二氧化硫有还原性,氯气有强氧化性,所以二氧化硫和氯气能发生氧化还原反应,氯水浅黄绿色褪去,离子反应方程式为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+,
故答案为:浅黄绿色褪去,SO2+Cl2+2H2O═SO42-+2Cl-+4H+;
③二氧化硫和氢氧化钙反应生成不溶于水的亚硫酸钙和水,亚硫酸钙和二氧化硫、水能反应生成可溶性的亚硫酸氢钙,离子反应方程式为:Ca2++2OH-+SO2=CaSO3 ↓+H2O;CaSO3+SO2+H20=Ca2++2HSO3-,
故答案为:先变浑浊,后又变澄清;
④二氧化硫有还原性,双氧水有强氧化性,所以二氧化硫和双氧水能发生氧化还原反应生成硫酸;碳酸盐和碳酸氢盐能与硫酸反应生成二氧化碳,若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有碳酸盐或碳酸氢盐;
故答案为:H2SO4;碳酸钠或碳酸氢钠;
点评 本题考查了二氧化硫的性质,难度不大,注意二氧化硫有漂白性,但二氧化硫不能漂白石蕊试液.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃和硫酸亚铁溶液长期暴露在空气中均易变质 | |
| B. | SO2和CO2通入CaCl2溶液中均无明显现象 | |
| C. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| D. | SO2、漂白粉、活性炭都能使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH${\;}_{4}^{+}$)大小顺序为:①>②>③ | |
| D. | 10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙难溶于水,所以碳酸钙属于非电解质 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化 | |
| D. | 将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com