
【题目】磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
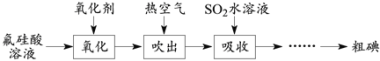
已知:①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;② I2 + I-![]() I3-。
I3-。
(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为____。从减少对环境污染的角度,上述氧化剂中可选用的有H2O2、____。
(2)生成的I2可用热空气吹出的原因是____。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是____(填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;②____。
(4)请补充完整证明氟硅酸溶液中存在I![]() 的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
【答案】4H++2NO2-+2I- = I2 + 2NO↑+2H2O NaClO I2受热易升华(或挥发) 含碘空气 增加吸收后溶液中I-浓度 加入CCl4振荡,静置,分液(或加CCl4萃取),有机层呈紫色(或加入5%淀粉溶液变蓝,再加入CCl4萃取) 取上层水溶液滴入5%淀粉溶液不变蓝,再分别滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,变蓝,证明存在I3-。
【解析】
利用碘及其化合物的氧化性、还原性,结合题目给出的信息,分析解答从含碘副产品提取粗碘的问题。
(1)NaNO2将I-氧化为I2,本身被还原成NO。“氧化”发生在酸性溶液(氟硅酸溶液)中,可用H+、H2O配平。该反应的离子方程式为4H++2NO2-+2I- = I2 + 2NO↑+2H2O。酸性溶液中,K2Cr2O7、H2O2、NaClO和NaNO2的还原产物分别是Cr3+、H2O、Cl-和NO,其中K2Cr2O7、Cr3+、NaNO2、NO会污染环境。故要减少污染,可选用H2O2、NaClO。
(2) I2受热易升华,故可用热空气吹出。
(3)“吸收”时发生反应I2 + SO2+2H2O=2HI+H2SO4。用“SO2水溶液”吸收“含碘空气”中的碘,应使气-液逆流充分接触,故吸收液(SO2水溶液)从吸收装置顶部喷下,“含碘空气”从吸收装置底部通入;从反应方程式可知,吸收液(SO2水溶液)反复多次循环吸收含碘空气,可提高SO2的利用率、增加溶液中I-浓度。
(4)据已知② I2 + I-![]() I3-,要证明氟硅酸溶液中存在I
I3-,要证明氟硅酸溶液中存在I![]() ,可证明该溶液中同时存在I2、I-。从“可选用的试剂”看,I2可直接用5% 淀粉溶液检验,或加CCl4萃取后下层呈紫色检验;I-需氧化为I2(0.1 mol·L-1 NaNO2溶液、6 mol·L-1 H2SO4溶液),再用5% 淀粉溶液检验。氟硅酸溶液中原有的I2会干扰I-检验,应当先用CCl4多次萃取分液除去。一种可能的方案:取少量氟硅酸溶液,加入CCl4振荡、静置,下层呈紫色,证明有I2。分液后取上层液体,重复上述操作,直至滴入5%淀粉溶液不变蓝,证明I2已完全除去。再滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,若变蓝,证明有I-。故原氟硅酸溶液中存在I3-。
,可证明该溶液中同时存在I2、I-。从“可选用的试剂”看,I2可直接用5% 淀粉溶液检验,或加CCl4萃取后下层呈紫色检验;I-需氧化为I2(0.1 mol·L-1 NaNO2溶液、6 mol·L-1 H2SO4溶液),再用5% 淀粉溶液检验。氟硅酸溶液中原有的I2会干扰I-检验,应当先用CCl4多次萃取分液除去。一种可能的方案:取少量氟硅酸溶液,加入CCl4振荡、静置,下层呈紫色,证明有I2。分液后取上层液体,重复上述操作,直至滴入5%淀粉溶液不变蓝,证明I2已完全除去。再滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,若变蓝,证明有I-。故原氟硅酸溶液中存在I3-。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
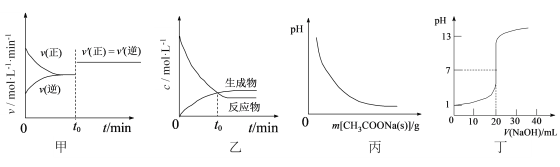
A. 图甲表示已达平衡的反应在t0时刻改变某一条件后,反应速率随时间的变化,则改变的条件可能是缩小容器体积
B. 图乙表示某可逆反应物质的浓度随反应时间的变化,且在t0时刻达到化学平衡状态
C. 图丙表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
D. 图丁表示用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一种酸性溶液中可能存在 NO3-、I- 、Cl- 、Fe3+ 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
A. 可能会有Fe3+ B. 一定会有 NO3-
C. 一定含有I- ,不能确定是否含Cl- D. 一定含有I- 、NO3-和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普拉西坦是一种能改善记忆、抗健忘的中枢神经药。下列关于普拉西坦的说法正确的是 ( )
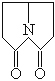
A. 一氯取代物只有5种
B. 二氯取代物只有5种
C. 可发生水解反应
D. 与2-氨基环丁二烯丙酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性废水中的NH4+可在一定条件下利用硝酸盐菌转化为NO3-,再用图示的电化学装置除去NO3-下列有关说法正确的是
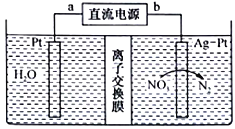
A. a端是直流电源的负极
B. 该装置把化学能转化为电能
C. 图中离子交换膜应为阴离子交换膜
D. 阴级的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com