
【题目】下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A. SO2、O2、HBr B. NH3、O2、N2
C. NH3、CO2、HCl D. H2、CH4、O2
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是____________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为_________________;
(3)计算该反应的平衡常数K=___________________________________________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1_______w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)________。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_______________极(填“正”或“负”),该电极反应式为_______________________________________。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,现在工业上脱硝有多种方法。试回答下列问题
I.采用NaClO2溶液作为吸收剂可进行脱硝。反应一段时间后溶液中离子浓度的分析结果如下表:

写出NaClO2溶液和NO反应的脱硝过程中主要反应的离子方程式:______________________.
Ⅱ.用焦炭还原法将其转化为无污染的物质也可进行脱硝。已知:
2C(s)+O2(g)=2CO(g) △H1=-221.0kJ·mol-1;
N2(g)+O2(g)=2NO(g) △H2=+180.5kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2 (g) △H3=-746.0kJ /mol
回答下列问题
(1)用焦炭还原NO生成无污染气体的热化学方程式为______________________.
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)

甲容器中,该反应的平衡常数K=_________丙容器的反应温度a__________400℃(填“>”,<”或“=”),理由是___________________________________.,用NH3催化还原NOx,也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
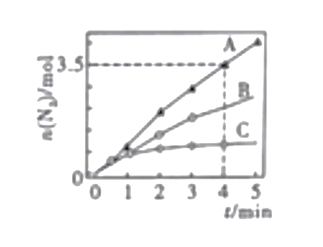
①在催化剂A的作用下0-4min的v(NO2)=___________________.
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是_____________,理由是_______________________________________.
③下列说法不正确的是____________(填序号)。
a.使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代中药学著作《新修本草》中关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色。”明末学者方以智所著《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽术不茂。”下列有关叙述正确的是
A. 赤色固体可能是Fe2O3 B. “青矾厂气“可能是CO和CO2
C. 青矾可能是NH4Al(SO4)2·12 H2O D. 青矾宜密闭贮藏,防止还原变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。下列有关说法正确的是( )
A. 氢制备工艺廉价易行,且储存方便
B. 燃料电池车中能量转化率为100%
C. 燃料电池车是直接将化学能转化为电能
D. 利用热电厂的电能电解蒸馏水制备氢气是一种环保之举
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有NA个H2O分子
B.常温常压下,22.4LCO2中碳原子数大于NA个
C.1L1mol·L-1的稀硝酸中,含氧原子数大于3NA
D.0.1mol/L Na2SO4溶液含Na+离子数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | Na[Al(OH)4] | Al(OH)3 |
B | AlCl3 | Al(OH)3 | Na[Al(OH)4] |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com