
【题目】Ⅰ.随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)画出f的原子结构示意图________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_____;比较g、h的最高价氧化物对应水化物的酸性强弱:______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________。
Ⅱ.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是第________周期、第________族。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是____,碱性最强的是____(填化学式)。
【答案】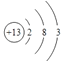 O2- >Na+ HClO4 > H2SO4
O2- >Na+ HClO4 > H2SO4 ![]() 三 ⅡA HNO3 Al(OH)3
三 ⅡA HNO3 Al(OH)3
【解析】
根据元素周期表和元素周期律分析解答;根据常见短周期元素化学性质分析解答。
Ⅰ.由图示提示可知,x元素原子半径最小,且最高正价为+1价,则x为H元素,y、z、d三种元素的原子半径大于H元素,小于e元素,则y、z、d三种元素位于第二周期,由最高正价和最低负价可知,y为C元素,z元素为N元素,d元素为O元素,e元素是短周期元素中原子半径最大的元素,则e为Na元素,由原子半径大小、最高正价和最低负价可知,f为Al元素,g为S元素,h为Cl元素。
(1)f为Al元素,它的原子结构示意图为: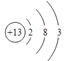 ;
;
(2)d、e常见离子为O2-和Na+,它们核外电子排布相同,核电荷数越大,离子半径越小,则离子半径:O2->Na+,g、h的最高价氧化物对应水化物为H2SO4、HClO4,其中非金属性:S<Cl,非金属性越强,最高价氧化物的水化物的酸性越强,则酸性:HClO4 > H2SO4;
(3)N和H元素可组成一种四原子共价化合物即NH3,其电子式为:![]() ;
;
Ⅱ.设m的核外电子数为a,则x的核外电子数为a+6,元素x的原子核外电子数是m的2倍,a+6=2a,解得a=6,y的氧化物具有两性可知:x为Mg元素,y为Al元素,m为C元素,n为N元素,
(1)元素x是Mg元素,它位于周期表的第三周期、第IIA族。
(2)m、n、y三种元素分别是C、N、Al,它们的最高价氧化物的水化物为H2CO3、HNO3、Al(OH)3,根据同周期从左到右最高价氧化物对应水化物酸性增强、碱性减弱,同主族从上到下最高价氧化物对应水化物酸性减弱、碱性增强,酸性最强的是HNO3,碱性最强的是Al(OH)3;


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
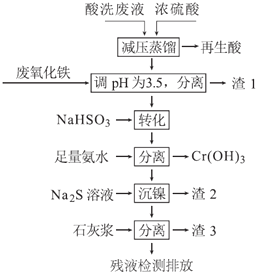
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+
(1)再生酸中含有______,采取减压蒸馏的原因是______(用化学方程式表示).
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是______.
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:______.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:______.
(5)滤渣3的主要成分为Ca(OH)2和_________________________.
(6)经检测,最后的残液中c(Ca2+)=0.004molL-1,则残液中F-浓度为______mgL-1,[已知Ksp(CaF2)=4×10-11mol3L-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 不溶于水的银盐见光都能分解
B. AgBr见光分解,可制作感光材料
C. AgI可用于人工降雨
D. AgCl、AgBr和AgI既不溶于水也不溶于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-有机化学基础]
已知:![]()
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
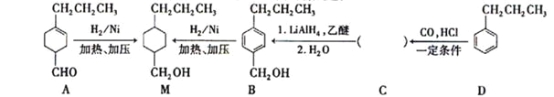
(1)常温下,下列物质能与A发生反应的有_______(填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是____,由C→B反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物![]() 和______(写结构简式)生成
和______(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是_____(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH3CH3b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化合物】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。

已知:
请回答:
(1)写出下列反应方程式
①B+D→E______________________________________。
②G→H________________________________________。
(2)①的反应类型为__________;②的反应类型为__________;F的结构简式为__________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体的结构简式。要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共享单车”,低碳环保,有益健身,方便出行。“最后一公里”,下列关于单车的制造材料说法正确的是( )
A.制造车轮钢圈的材料是合金B.铝合金制造的车架较钢制造的重
C.制造轮胎用的橡胶有固定的熔点D.制作反光板的有机玻璃属于硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1)和金刚烷(图2),下列说法正确的是
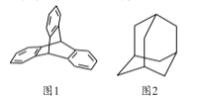
A. 三蝶烯的分子式为C20H16
B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃
D. 三蝶烯和金刚烷的一氯代物均只有二种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感光性高分子作为新材料在各种领城中得到广泛应用。感光高分子F的一种合成路线如下:己知:A的相对分子质量为60,核磁共振氢谱显示为两组峰,峰面积比为1∶3。回答下列问题:
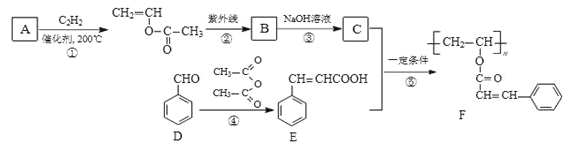
(1)A的结构简式为_______,D的化学名称是____________________。
(2)①、②的反应类型分别是____________________。
(3)反应③的化学方程式是____________________。
(4)F中的官能团有_______________(填官能团名称)。
(5)芳香族化合物G是E的同分异构体,能发生银镜反应且分子中只有4种不同化学环境的氢。写出三种G的结构简式:_____________________________________________。
(6)写出以甲苯为原料(其他无机试剂任选)制备化合物D的合成路线:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com