
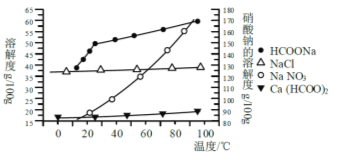
����Ŀ������ƹ㷺����ʳƷ��������ʯ�͵ȹ�ҵ�����ϣ�300��400�����ҷֽ⣮
����ʵ������ȡ�ķ���֮һ�ǣ�Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2����
ʵ������ȡʱ������ҵ���������ƺͼ�ȩ���μ��뵽��������Ϊ30-70%�Ĺ���������Һ��(Ͷ�����ʵ���֮������Ϊ1:2:1.2)�����տɵõ���������98%�������ؽ����������͵����ʲ�Ʒ��
(1)������������������Զ࣬��Ŀ����____________��
(2)��Ӧ�¶���ÿ�����30-70��֮�䣬�¶Ȳ��˹��ߣ�����Ҫԭ����____________��
(3)�Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ�������Ƶ�Ŀ����____________��
(4)ʵ��ʱ��ǿ������45min����Ŀ����____________���������������Һ��pH 7��8����Ŀ����____________����ᾧ���롢����ò�Ʒ��
����ij�о���ѧϰС���ù�ҵ̼���(��Ҫ�ɷ�ΪCaCO3������Ϊ��Al2O3��FeCO3) Ϊԭ�ϣ����Ʊ������Σ������������Һ�����ȡ����ƣ������ͼ�������ʵ��ܽ������������ؽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0molL-1����)��
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
�벹��������̼����Ʊ�����Ƶ�ʵ�鷽����
����һ����ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�
�������____________��
��������____________��
�����ģ����˺���Һ���������Һ��ϣ�������ҺpH7-8����ֽ��裬������Һ���� �� ��ϴ�ӡ�60������ü���ƾ��塣
�ṩ���Լ��У�a�������ƣ�b��5molL-1���ᣬc��5molL-1���ᣬd��5molL-1���ᣬe.3%H2O2��Һ��f������ʯ��ˮ��
���𰸡�
����(1)ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ�
(2)��ֹH2O2�ֽ�ͼ�ȩ�ӷ���
(3)��ȥ�ؽ������ӣ�
(4)ʹ��Ӧ���ֽӴ���Ӧ����߲��ʣ���ֹ�����ˮ�⣻
�������Թ��������ܽ�̼�����Ʒ����ʯ��ˮ������ҺpH=5������Ũ�������ȹ���
��������
�������������(1)��ѧ��Ӧ��һ�ַ�Ӧ�����Ŀ���Ǵٽ�������Ӧ���ַ�Ӧ�����ת���ʣ���ӹ����Ĺ���������ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ��ʴ�Ϊ��ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ�
(2)�¶Ƚϸ�ʱ��˫��ˮ�ֽ⣬��ȩ�ӷ�����Ӧ�¶���ÿ�����30-70��֮�䣬�¶Ȳ����ߣ��ܷ�ֹH2O2�ֽ�ͼ�ȩ�ӷ����ʴ�Ϊ����ֹH2O2�ֽ�ͼ�ȩ�ӷ���
(3)�Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ���������ؽ������ӽ�������������������ˮ�����Գ�ȥ�ؽ������ӣ��ʴ�Ϊ����ȥ�ؽ������ӣ�
(4)������ʹʹ��Ӧ���ֽӴ���ʹ�䷴Ӧ��ȫ����߲��ʣ����������Ϊ��������ӣ�������ˮ���������ԣ�������ҺpH 7��8����ҺΪ�����������Ƽ����ˮ�⣬�ʴ�Ϊ��ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣻
������ʵ������Ҫȥ�����ʣ�ͬʱ���ɿ����Ը��Σ�������������������Ҫ����Ϊ������(˫��ˮ������)������������������ȥ��������ҲҪ���ɼ��ȥ���ʵ���pHΪ5(��ʯ��ˮ����)��Ȼ������������Һ��������ܽ�Ƚ�С�����¶ȱ仯�������Ǽ���ƣ�������Ũ�����õ�����ƹ��壬���ȹ��ˣ���ֹ�������������������IJ���Ϊ������1����ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�����2�����Թ��������ܽ�̼�����Ʒ������3����ʯ��ˮ������ҺpH=5������4�����˺���Һ���������Һ��ϣ�������ҺpH 7��8����ֽ��裬������Һ������Ũ�������ȹ��ˡ�ϴ�ӡ�60��ʱ����ü���ƾ��壬�ʴ�Ϊ�����Թ��������ܽ�̼�����Ʒ����ʯ��ˮ������ҺpH=5�����ȹ��ˡ�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ��ȥCO��������CO2 | ͨ����������CuO |
B | ��ȥCuCO3��Һ�е����� CuO | ��������ϡH2SO4���� |
C | �������ʯ��ˮ��NaOH��Һ | ����ϡHCl |
D | ����Ӳˮ����ˮ | �������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȸʯ��һ�ֺ�ͭ��ʯ����ͭ��̬ΪCuCO3Cu(OH)2��CuSiO32H2O��ͬʱ����SiO2��FeCO3��Fe2O3��Al2O3�����ʡ�����Ϊԭ����ȡ����ͭ�Ĺ���������ͼ��

(1)��ɲ������ϡ������CuSiO32H2O��Ӧ�Ļ�ѧ����ʽ��
CuSiO32H2O+H2SO4=CuSO4+_______+H2O��˫��ˮ��������______________��
(2)����ڵ�����ҺpH������ѡ�õ��Լ���______��
A��CuO B��Fe2O3 C��Al2O3 D��Cu(OH)2
(3)�й��������↑ʼ��������ȫ������pH���±���
�������� | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 |
������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 |
������У�����pH=4ʱ����������B�ijɷֵĻ�ѧʽΪ______________����ҺB�г�Cu2+��,�����еĽ�����������______________��
(4)����ҺBͨ��______________��______________�����˵Ȳ����ɵõ�����ͭ���塣
(5)�ⶨ����ͭ����ᾧˮ�ĺ���ʱ��Ӧ�������______________�����ա�����ʧˮ�����ڿ�������ȴ�������ⶨ���______________(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̻�����������ˮ���ص���(���� )
A. ������Һȥ���� B. ���ڳ�ʪ�Ļ���������
C. �����Ȼ�����Һ��ɫ���� D. Ũ������Һ�г�ζ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������л��ϳɲ��ϵ����� ��
A��������ϩ B����ľ���� C���л����� D���ֻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Al2(SO4)3��K2SO4�������Ļ����Һ��,���c(SO42-)����0.2mol/L,������������0.2mol/L��KOH��Һʱ,���ɵij���ǡ���ܽ�,��ԭ�����Һ��K+�����ʵ���Ũ��Ϊ
A��0.2mol/L B��0.25mol/L C��0.45mol/L D��0.225mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ����
A��18O2-�ṹʾ��ͼ��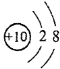
B���������Ľṹ��ʽ��![]()
C��NaHSO4����ʱ���뷽��ʽ��NaHSO4= Na++ HSO4-
D��ģ�� �ɱ�ʾ������ӻ����Ȼ�̼����
�ɱ�ʾ������ӻ����Ȼ�̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1molij��ѧ�������ĵ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ�ġ�H���ڷ�Ӧ����ܼ�������������ܼ���֮���ҵ�ϸߴ����ͨ�����з�Ӧ��ȡ��SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)���÷�Ӧ�ķ�Ӧ�ȡ�HΪ
Si(s)+4HCl(g)���÷�Ӧ�ķ�Ӧ�ȡ�HΪ

A��+412kJ/mol B��-412kJ/mol C��+236kJ/mol D��-236kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���õ����ز�����ͭ��װ����ͼ��ʾ���˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4�����й��ڸõ������������ǣ� ��
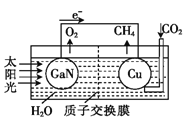
A����ع���ʱ���ǽ�̫����ת��Ϊ����
B�� ͭ�缫Ϊ�������缫��ӦʽΪ��CO2��8e����8H����CH4��2H2O
C������ڲ�H+�����ӽ���Ĥ���������ƶ�
D��Ϊ��߸��˹����ϵͳ�Ĺ���Ч�ʣ�����װ���м�������������Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com