

分析 由流程可知,废弃的铝铁合金加入氢氧化钾溶液浸泡反应铝反应得到偏铝酸钾溶液,过滤,滤液经一系列操作反应生成硫酸铝钾,滤渣中加入稀硫酸和铁反应生成硫酸亚铁,加入稀硝酸氧化为硫酸铁,加入试剂Y调节溶液PH,但不能引入新的杂质,加入氧化铁和酸反应来调节溶液PH,酸性越强,对铁离子水解程度抑制越大,生成氢氧化铁少,得到溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到聚合生成聚合硫酸铁,
(1)明矾是一种常见铝钾硫酸盐,所以为充分利用原料,试剂X应为氢氧化钾;铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,反应中有强碱溶液反应且放出气体需要放置腐蚀作用;
(2)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质净水的作用;
②聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇可以利于聚合硫酸铁析出,乙醇易挥发分析;
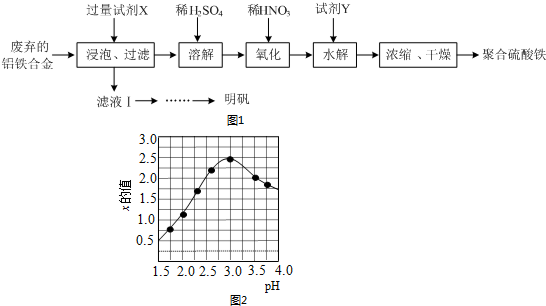
③加入氧化铁和酸反应来调节溶液PH,不引入新的杂质,图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制;
(3)铝铁合金的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,电解池的阳极材料是活泼电极时,则该电极反应是金属本身失电子的过程,阴极发生阳离子的得电子过程;
(4)发生反应Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,设Fe、Al的物质的量分别为x、y,结合方程式表示出氢气的物质的量,再根据二者质量、氢气体积列方程组计算;
解答 解:由流程可知,废弃的铝铁合金加入氢氧化钾溶液浸泡反应铝反应得到偏铝酸钾溶液,过滤,滤液经一系列操作反应生成硫酸铝钾,滤渣中加入稀硫酸和铁反应生成硫酸亚铁,加入稀硝酸氧化为硫酸铁,加入试剂Y调节溶液PH,但不能引入新的杂质,加入氧化铁和酸反应来调节溶液PH,酸性越强,对铁离子水解程度抑制越大,生成氢氧化铁少,得到溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到聚合生成聚合硫酸铁,
(1)废弃的铝铁合金中,铝是两性元素,可以和强酸强碱溶液发生反应,试剂X应为氢氧化钾;铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,2Al+2OH-+2H2O=2AlO2-+3H2↑,反应中有强碱溶液反应且放出气体需要放置腐蚀作用,应铁腐蚀性的警示标志,
故答案为:KOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;B;
(2)①聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,具有较大表面积能吸附悬浮杂质,有净水的作用,聚合硫酸铁可用于净水的原理是具有吸附作用,
故答案为:聚合硫酸铁具有吸附;
②聚合硫酸铁微溶于乙醇,浓缩时向其中加入一定量的乙醇,可以降低聚合硫酸铁的溶解度利于聚合硫酸铁析出,乙醇易挥发得到晶体易于干燥;
故答案为:降低聚合硫酸铁的溶解度,以便析出,所得产物易于干燥;
③加入氧化铁和酸反应来调节溶液pH,所加试剂Y为Fe2O3,不引入新的杂质;图象分析可知PH<3,x值越小,是因为酸性条件下铁离子水解被抑制,分析pH过小(pH<3)导致聚合硫酸铁中x的值减小,
故答案为:Fe2O3;pH过小,会抑制Fe3+的水解;
(3)电解池的阳极材料是铝铁合金时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-=Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-=3H2,故答案为:阳极;
(4)设Fe、Al的物质的量分别为x、y,则:
Fe+2H+=Fe2++H2↑
x x
2Al+6H+=2Al3++3H2↑
y 1.5y
根据二者质量,可得56g/mol×x+27g/mol×y=11.0g
根据生成氢气的体积,有:x+1.5y=$\frac{8.96L}{22.4L/mol}$
联立方程,解得:x=0.1mol,y=0.2mol,
故混合物中Al与Fe的物质的量之比为0.2mol:0.1mol=2:1;
故答案为:2:1;
点评 本题考查了物质分离提纯的实验过程分析、混合物的有关计算、物质性质的理解应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
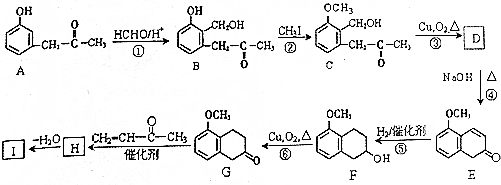
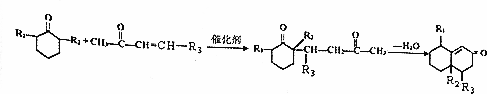
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2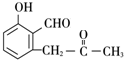 +2H2O.
+2H2O.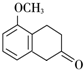 +
+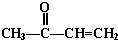 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$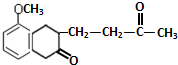 .
.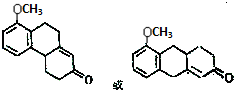 .
.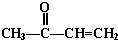 的流程图
的流程图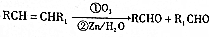 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4; 途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | 78gNa2O2中存在的共价键总数为NA(NA为阿伏伽德罗常数的值) | |
| D. | 18gD2O中含有的质子数为10NA(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
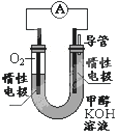 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
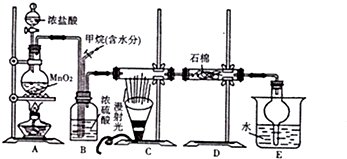
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com