
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5mol/(L·s)B. v(B)=0.3mol/(L·s)
C. v(C)=0.8mol/(L·s)D. v(D)=1.0mol/(L·s)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向20 mL某物质的量浓度的AlCl3溶液中滴入2 mol·L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
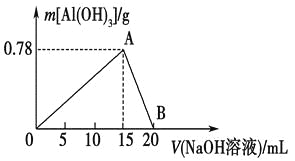
(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是_________________________。
(3)上述两步反应用总的离子方程式可表示为:____________________________。
(4)若所得Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
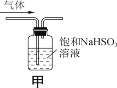
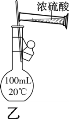
A.可用干燥的pH试纸测量氯水的pH
B.蒸干FeCl3溶液制无水FeCl3固体
C.用装置甲除去SO2中的少量HCl
D.用装置乙配制100 mL 0.50 mol·L-1硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。不仅可以制备物质,还可以提纯和净化。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离了交换膜只允许阳离子通过,请回答以下问题:
①图中A极要连接电源的_______(填“正”或“负”)极
②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出。(选填“a”“b” “c” “d” “e”或“f”)

③电解总反应的离子方程式是_____________。
(2)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示

①电源正极为____(填A或B),阴极反应式为_____________。
②若电解过程中转移了5mol电子,则膜左侧电解液的质量变化为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(s)的能量变化如图所示,下列叙述正确的是

A. 该反应为放热反应
B. A—B的键能为bkJmol-1
C. 加催化剂能降低该反应焓变
D. 该反应的反应热为△H=(a-b)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 燃烧热是指1mol物质完全燃烧时放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
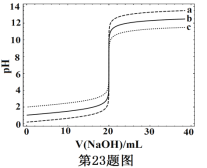
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com