
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
【答案】B
【解析】
A. 当Fe过量时,Fe3+将被Fe还原为Fe2+,所以稀硝酸和过量的铁屑反应,离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,A不正确;
B. 向Ca(HCO3)2溶液中加入过量NaOH溶液,因为NaOH过量,所以参加反应的Ca2+、HCO3-符合组成1:2关系,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,B正确;
C. HCO3-+H2O![]() CO32-+H3O+,此反应式为碳酸氢钠的电离方程式,C不正确;
CO32-+H3O+,此反应式为碳酸氢钠的电离方程式,C不正确;
D. Fe(OH)3溶于氢碘酸中,I-将Fe3+还原,离子方程式为:2Fe(OH)3+6H++2I-=2Fe++I2+6H2O,D不正确。
故选B。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】如下图,CPAE是蜂胶的主要活性成分,也可由咖啡酸合成.下列说法不正确的是

A.咖啡酸分子中所有碳原子可能处在同一个平面上
B.1molCPAE与足量的溴水反应,最多消耗3molBr2
C.1mol苯乙醇在O2中完全燃烧,需消耗10molO2
D.1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的化学式为C8H10,能使酸性KMnO4溶液褪色。
(1)若分子中含有一个苯环,则该烃属于_____,是_____的同系物。该烃具有_____种同分异构体。
(2)若为链烃且有两个甲基取代基,写出一种分子中只含叁键的同分异构体的结构简式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在光照条件下,将1mol CH4与Cl2反应,得到等物质的量的4种有机取代物,则消耗Cl2物质的量为
A.2.5molB.2molC.1molD.10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:
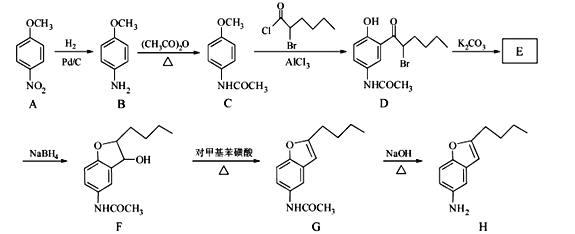
(1)D中的含氧官能团名称为_____________(写两种)。
(2)F→G的反应类型为_____________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式_________________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子式为C14H17O3N,写出E的结构简式_____________。
(5)G→H的反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是:______________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:![]()
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=_______________,H2的转化率为_______________,该反应在此温度下的化学平衡常数为_______________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是____________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_____________________。

(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g) +6H2O(l) ![]() 4NH3(g) +3O2(g) △H = a kJ/mol
4NH3(g) +3O2(g) △H = a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com