
����Ŀ����ѧ��һֱ�����ڡ��˹��̵����ķ����о���
��1��Ŀǰ�ϳɰ��ļ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3(g) ��H �÷�Ӧ�������仯��ͼ��ʾ��
2NH3(g) ��H �÷�Ӧ�������仯��ͼ��ʾ��

���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�ǣ�______________�������������С�����䡱����
�ڽ�һ������N2(g)��H2(g)����2L���ܱ������У���500�桢2��107Pa�·������·�Ӧ��![]()
5���Ӻ�ﵽƽ�⣬���N2Ϊ0.2 mol��H2Ϊ0.6 mol��NH3Ϊ0.2 mol��������ƽ����Ӧ����v(N2)��_______________��H2��ת����Ϊ_______________���÷�Ӧ�ڴ��¶��µĻ�ѧƽ�ⳣ��Ϊ_______________���������ձ���С�����һλ��
������ߢ�������H2��ת���ʣ����д�ʩ���е���____________��
A���������а�ԭ�����ٳ���ԭ����
B�����������ٳ����������
C���ı䷴Ӧ�Ĵ���
D��Һ��������������
��2��1998��ϣ������ʿ��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+�����Ӷ�ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ�����ʵ��װ����ͼ��ʾ�������ĵ缫��ӦʽΪ_____________________��

��3���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��
2N2(g) +6H2O(l) ![]() 4NH3(g) +3O2(g) ��H = a kJ/mol
4NH3(g) +3O2(g) ��H = a kJ/mol
��һ���о�NH3���������¶ȹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
T/K | 303 | 313 | 323 |
NH3������/��10��6mol�� | 4.8 | 5.9 | 6.0 |
�˺ϳɷ�Ӧ��a_________0��������ڡ�����С�ڡ����ڡ���
���𰸡���С0.01mol��L��1��min��133.3%3.7 L2/mol2A DN2 + 6H+ + 6e�� = 2NH3����
��������
�����������1����������������ͷ�Ӧ�Ļ�ܣ�
����������ʽ���㣻
���������������ƽ��״̬��Ӱ�������
��2���������������õ����ӵĻ�ԭ��Ӧ��
��3�������¶������������֮��Ĺ�ϵ�жϡ�
��������1����������������ͷ�Ӧ�Ļ�ܣ���E1��E2����С��
�� ![]()
��ʼŨ�ȣ�mol/L�� 0.15 0.45 0
ת��Ũ�ȣ�mol/L�� 0.05 0.15 0.1
ƽ��Ũ�ȣ�mol/L�� 0.1 0.3 0.1
����������ƽ����Ӧ����v(N2)��0.05mol/L��5min��0.01mol/(L��min)��H2��ת����Ϊ![]() ���÷�Ӧ�ڴ��¶��µĻ�ѧƽ�ⳣ��Ϊ
���÷�Ӧ�ڴ��¶��µĻ�ѧƽ�ⳣ��Ϊ![]() ��
��
��A���������а�ԭ�����ٳ���ԭ�����൱������ѹǿ��ƽ��������Ӧ������У�ת������ߣ�A��ȷ��B�����������ٳ����������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���ת���ʲ��䣬B����C���ı䷴Ӧ�Ĵ������ܸı�ƽ��״̬��ת���ʲ��䣬C����D��Һ��������������������������Ũ�ȣ�ƽ��������Ӧ������У�ת������ߣ�D��ȷ����ѡAD��
��2�����ص������õ����ӣ������������õ����ӣ�������ԭ��Ӧת��Ϊ�������缫��ӦʽΪN2 + 6H+ + 6e����2NH3��
��3�����ݱ������ݿ�֪�����¶Ȱ����������ӣ�˵�������¶�ƽ��������Ӧ������У�����Ӧ�����ȷ�Ӧ����a��0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����зǼ��Թ��ۼ������ӻ�������ǣ�������
A.NH4NO3
B.Cl2
C.H2O2
D.Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ʒ�ںϳɡ�ҽҩ��Ⱦ�ϵȹ�ҵ���й㷺��;����ṹʽ��ͼ��ʾ������ȩˮ��Һ�백ˮ����������Ƶ�������Ʒ����ԭ����ȫ��Ӧ����������Ʒ�����ȩ�백�����ʵ���֮��Ϊ

A. 1��1 B. 2��3 C. 3��2 D. 2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������ݸ�Ŀʰ�š��м���ҩ��dz�ˮ����д���������Բ���ƿ��������ڣ���ʹй������ҩ���������������ң������ԣ����в������ᣮ����������֮�������ã����������������ġ��dz�ˮ����ָ�� ��
A.��ˮ
B.����
C.��
D.±ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ��������з�Ӧ��aX(g)��bY(s)nW(g) ��H��Q kJ��mol��1��ij��ѧ��ȤС���ͬѧ���ݴ˷�Ӧ�ڲ�ͬ�����µ�ʵ�����ݣ���������������ͼ��

���У�w(W)��ʾW�����������еİٷֺ�����t��ʾ��Ӧʱ�䡣������������ʱ�����з�����ȷ����( )
A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2>p1��a<n
B��ͼ���������ͬ��ͬѹ�´����Է�Ӧ��Ӱ�죬��2ʹ�õĴ���Ч����
C��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1>p2��n��a��b
D��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1>T2��Q<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��10�£��㽭����ѧ�����������������أ�C15H22O5�������ŵ��������ѧ��ҽѧ�����������ʵķ��࣬���������ڣ� ��
A.����������
B.���
C.��������
D.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����������ͬѧ�ֱ��������ͼһ��ͼ����ʾ��ʵ�顣
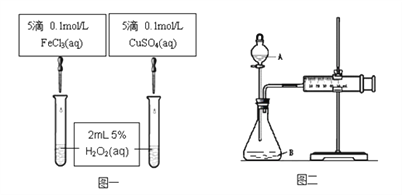
��1�� ͼһ��ͨ���۲�____________________���������ԱȽϵó����ۡ���ͬѧ�����CuSO4��ΪCuCl2��Ϊ��������������__________________������Ϊ���������������ָĽ��� _____________________��
��2�� ͼ�������ڶ����ȽϷ�Ӧ�Ŀ��������ͼ��װ�������Եķ�����________________��
����ͼ����ʵ��ʱ�������������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��1 mol�κ����ʶ�����6.02��1023������
B����״���£�1 mol H2��1 mol H2O��ռ�������ԼΪ22.4 L
C��HNO3��Ħ��������63 g
D��0.5 mol 13Hԭ�Ӻ��е�������ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ԭ�����͵���
A. �����ڳ�ʪ�Ŀ�������������
B. �غ�ɫNO2��ѹ����ɫ�ȱ�����dz
C. ���¼������������ʹ�ϳɰ��ķ�Ӧ���ʼӿ�
D. H2��I2��HIƽ��������ѹ����ɫ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com