
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
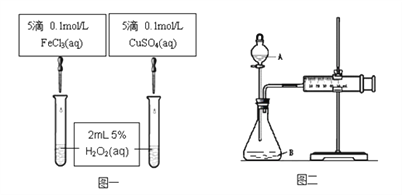
(1) 图一可通过观察____________________现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________,你认为还可以作其他何种改进? _____________________。
(2) 图二可用于定量比较反应的快慢,检查图二装置气密性的方法是________________。
利用图二做实验时需测量的数据是_____________________。
【答案】反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度)控制阴离子相同,排除阴离子的干扰将FeCl3改为Fe2(SO4)3关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位,如回到原位证明气密性良好一定时间内收集到的气体体积或收集一定体积的气体所需要的时间
【解析】
试题分析:(1)产生气泡的快慢可以定性确定双氧水的分解速率大小,根据物质的微粒不同分析;
(2)根据乙图装置来选择气密性的检查方法;该反应是通过反应速率分析的,所以根据反应速率的表达式来判断.
解析:(1)可以通过观察产生气泡的快慢来定性比较比较Fe3+和Cu2+对H2O2分解的催化效果,将CuSO4改为CuCl2更为合理,这样Fe3+和Cu2+中的阴离子种类相同,可以排除因阴离子的不同可能带来的影响,还可以把氯化铁改为硫酸铁;
(2)结合乙图装置,该气密性的检查方法为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;反应是通过反应速率分析的,根据v=△V/△t,实验中需要测量的数据收集一定体积的气体所需要的时间或一定时间内收集的气体体积。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图。下列说法不正确的是( )
已知:

①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示.

(1)A的分子式是__________; B中的含氧官能团名称是______________________.
(2)A→C的反应类型是_______________;A~D中互为同分异构体的是______________(填代号).
(3)由A生成B的化学方程式是:_____________________________________________.
(4)C在一定条件下发生加聚反应的化学方程式是:______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是:______________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:![]()
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=_______________,H2的转化率为_______________,该反应在此温度下的化学平衡常数为_______________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是____________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_____________________。

(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g) +6H2O(l) ![]() 4NH3(g) +3O2(g) △H = a kJ/mol
4NH3(g) +3O2(g) △H = a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中正确的是
A. 金属原子的核外电子在金属晶体中都是自由电子
B. 镁型和铜型的原子堆积方式空间利用率最高
C. 金属原子在化学变化中失去的电子数越多,其还原性越强
D. 温度升高,金属的导电性将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A. 7.8 g Na2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023
B. 2 mol NO和1 mol O2混合在密闭容器中,容器内物质分子数小于2×6.02×1023
C. 6.8 g熔融的KHSO4中含有0.1NA个阳离子
D. 1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3、K2SO4的混合溶液中,如果c(SO42-)=0.2 mol/L,c(Al3+)=0.1 mol/L,则原混合溶液中K+的物质的量浓度为( )
A.0.2 mol/L B .0.25 mol/L C.0.225 mol/L D. 0.1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com