
【题目】碳是形成化合物种类最多的元素,其单质及形成的化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成物质N,其能量变化如图所示。则M、N相比,较稳定的是________(填“M”或“N”)。

(2)已知:
C(s)+H2O(l)=CO(g)+H2(g) △H1=a kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3=c kJ·mol-1
则C(s)+O2(g)=CO2(g) △H=______(用a、b、c表示)kJ·mol-1。
(3)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H=_________。
化学键 | C-H | C-F | H-F | F-F |
键能(KJmol-1) | 414 | 489 | 565 | 155 |

(4)在一恒容的密闭容器中,加入1 mol CO(g)、2 mol H2O(g),发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。
H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。

①该反应的△H________(填“<”或“>”)0。
②在体积不变时,要增大该反应的正反应速率可采取的措施是_________(任写一条)。
③A点时该反应的平衡常数为___________(精确到0.01)。
【答案】M ![]() -1940KJmol-1 < 升高温度;使用催化剂;充入CO或H2O(g)(任写一条,1分) 0.17
-1940KJmol-1 < 升高温度;使用催化剂;充入CO或H2O(g)(任写一条,1分) 0.17
【解析】
(1)能量越低越稳定;
(2)根据化学方程式合并的思想,提问中的化学方程式可由前三个方程式推导得到,焓变也要跟着相应变化;
(3)△H=反应物键能之和-生成物键能之和;
(4)①由图温度升高CO转化率减小,所以平衡逆向移动,则正反应是放热反应;
②升高温度、增加反应物浓度、使用催化剂都可以加快化学反应的速率;
③平衡常数为K=![]() 。
。
(1)有机物M经过太阳光光照可转化成N,△H=+88.6![]() ,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;故答案为:M;
,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;故答案为:M;
(2)已知:
①C(s)+H2O(l)=CO(g)+H2(g) △H1=a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=c kJ·mol-1
则化学方程式C(s)+O2(g)=CO2(g)可以看成是[2![]() ①+②+③]
①+②+③]![]()
![]() 得到的,所以该反应焓变△H=△H1+
得到的,所以该反应焓变△H=△H1+![]() ,故答案为
,故答案为![]() ;
;
(3)△H=反应物键能之和-生成物键能之和,结合图表中键能数据可知△H=![]() =-1940kJmol-1,故答案为-1940kJmol-1;
=-1940kJmol-1,故答案为-1940kJmol-1;
(4)①由图温度升高CO转化率减小,所以平衡逆向移动,正反应是放热反应,所以△H <0,故答案为:<;
②升高温度、增加反应物浓度、使用催化剂都可以加快化学反应的速率,所以可以通过升高温度、使用催化剂、充入CO或H2O来加快化学反应速率,故答案为:升高温度、使用催化剂、充入CO或H2O;
③设容器体积为V,则平衡常数为K= =0.17,故答案为:0.17。
=0.17,故答案为:0.17。


科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
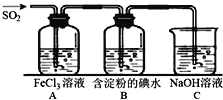
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )

A.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
B.该分子中的所有碳原子可能共平面
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为V L的恒容密闭容器中通入1 mol CH3Cl(g)和1 mol H2O(g),体系内同时存在下列两个平衡:
反应①:CH3Cl(g)+H2O(g)![]() CH3OH(g)+HCl(g) K1
CH3OH(g)+HCl(g) K1
反应②:2CH3OH(g)![]() (CH3)2O(g)+H2O(g) K2
(CH3)2O(g)+H2O(g) K2
反应t min后体系达到平衡,此时(CH3)2O(g)的物质的量为9×10-3mol,CH3Cl(g)的平衡转化率为4.8%,回答下列问题:
(1)0~t min内,CH3Cl(g)的反应速率为___________。
(2)反应达到平衡时,CH3OH(g)的物质的量为___________。
(3)计算反应②的平衡常数K2=___________。
(4)当反应到达平衡时,再向体系内通入一定量的CH3OH(g),下列说法正确的是________(填字母)。
A.反应①的平衡逆向移动,反应②的平衡不发生移动
B.平衡时反应①、反应②的反应速率都增大
C.K1增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-次氯酸盐电池的工作原理如图,该电池反应为:
Mg+ClO-+H20=Mg(0H)2+Cl-。下列有关说法正确的是

A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,C溶液中的溶质是MgCl2
C.负极反应式:ClO- +2e- +H20 = Cl- +20H-
D.b电极发生还原反应,每转移0.2mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是

A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种
B.(CH3)2CHCl在浓硫酸作用下发生消去反应只得到一种烯烃
C.含有5个碳原子的饱和链烃,其一氯取代物共有8种
D.与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:
丙烯![]()
![]()
![]()
![]()
![]()
![]()
![]() 双酚A
双酚A
下列说法正确的是( )
A. 1 mol 双酚A最多可与2 mol Br2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]() +O2
+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com