
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水DO。

Ⅰ.测定原理:
碱性条件下,O2将 Mn2+氧化为 MnO(OH)2;①2Mn2++O2+4OH-=2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2;②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-。
Ⅱ.测定步驟
a.安装装置,检验气密性,充N2排尽空气后,停止充N2.。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000ml·L-1Na2SO3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题
(1)配制以上无氧溶液吋,除去所用溶剂水中氧的简单操作为_____________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为___________________。
①滴定管 ②注射器 ③量筒
(3)步骤f为_________________。
(4)步骤e中达到滴定终点的标志为__________________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=________mg·L-1(保留一位小数)。若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则所测的值_________(填:偏高、偏低、无影响)
【答案】 将溶剂水加热煮沸 ② 重复e步骤操作2—3次 加入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且30s内不变色 9.0 偏低
【解析】(1). 溶液中氧气溶解度不大,且随温度升高溶解度减小,所以配制以上无氧溶液时需要通过煮沸溶剂,把溶剂水中溶解的氧气赶出得到,故答案为:将溶剂水加热煮沸;
(2). 加入水样需要避免空气进入三颈瓶,橡皮塞处用中注射器把水样注入,在橡胶塞处加入水样及有关试剂应选择的仪器是②,滴定管和量筒无法实现加入水样的目的,故答案为:②;
(3) 为减少实验过程中的误差,滴定实验应重复进行测定数值,取几次的平均值计算,步骤f为重复e步骤操作23次,故答案为:重复e步骤操作23次;
(4). 用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32+I2═S4O62+2I,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴,溶液蓝色变为无色且30s内不变色,说明反应达到终点;
若某次滴定消耗Na2S2O3溶液4.50mL,由2Mn2++O2+4OH-=2MnO(OH)2↓、MnO(OH)2+2I+4H+=Mn2++I2+3H2O、2S2O32+I2═S4O62+2I,得到定量关系为:
O22MnO(OH)22I24S2O32,
1 4
n 0.0045L×0.01000molL1
n=1.12×105mol,200mL水样中含氧气1.12×105mol×![]() =5.6×105mol,氧气浓度 = 5.6×105mol÷0.2L=2.8×104mol/L,水中溶氧量(DO) = 2.8×104mol/L×32g/mol=8.96×103g/L≈9.0mg/L
=5.6×105mol,氧气浓度 = 5.6×105mol÷0.2L=2.8×104mol/L,水中溶氧量(DO) = 2.8×104mol/L×32g/mol=8.96×103g/L≈9.0mg/L
若滴定开始时仰视滴定管刻度,会使初始读数偏高,滴定结束时俯视滴定管刻度,会使终止读数偏低,因标准溶液的体积 = 终止读数-初始读数,所以测得的标准溶液的体积偏小,滴定结果偏低;
故答案为:加入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且30s内不变色;9.0;偏低。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的![]() ,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述正确的是:
,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述正确的是:
A. 原子半径:rW>rZ>rY
B. 化合物X2Y、ZY、ZX2中化学键的类型相同
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 由Y元素形成的离子与W元素形成的离子的电子数不可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )

A. 用图1装置将硫酸铜溶液直接蒸干得到胆矾 B. 图2装置可用于收集氨气并进行尾气吸收
C. 用图3装置电解精炼铝 D. 图4装置可以用于实验室制备Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2(g)+3H2(g)2NH3(g),500℃时在容积为10L的密闭容器中进行,开始时加入1mol N2和6mol H2 , 则达到平衡时,NH3的浓度不可能达到( )
A.0.1 molL﹣1
B.0.2 molL﹣1
C.0.05 molL﹣1
D.0.15 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
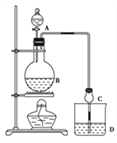
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是_____________________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式_____________________________;
(2)球形干燥管C的作用是______________________;若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是______________________;反应结束后D中的现象______________________;
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能够使碳链减短的是( )
①烯烃被酸性KMnO4溶液氧化②乙苯被酸性KMnO4溶液氧化③重油裂化为汽油④CH3COOCH3和NaOH溶液共热⑤炔烃与溴水反应
A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸在一定条件下所形成的聚酯的结构简式为![]() ,该酯可以作为新型的餐具原料。由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解。下列有关这种新型的可降解塑料的叙述正确的是( )
,该酯可以作为新型的餐具原料。由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解。下列有关这种新型的可降解塑料的叙述正确的是( )
A. 降解塑料是一种纯净物
B. 其生产过程中的聚合方式与聚苯乙烯相似
C. 它属于一种线型高分子材料
D. 其相对分子质量为72
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.σ键是镜面对称,而π键是轴对称
C.O2 分子中含π键,是由两个 p 轨道“肩并肩”重叠形成的
D.当原子形成分子时,首先形成σ键,可能形成π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com