
| A. | 乙烯发生加聚反应制得聚乙烯高分子材料 | |
| B. | 用甲烷与氯气制备一氯甲烷 | |
| C. | 用苯和浓硫酸、浓硝酸为原料制取硝基苯 | |
| D. | 用石灰石和稀盐酸反应制得二氧化碳 |
分析 A.乙烯发生加聚反应制得聚乙烯高分子材料是加聚反应;
B.甲烷与氯气制备一氯甲烷,属于取代反应,伴随很大副反应;
C.用苯和浓硫酸、浓硝酸为原料制取硝基苯属于取代反应;
D.用石灰石和稀盐酸反应制得二氧化碳,属于复分解反应.
解答 解:A.乙烯发生加聚反应制得聚乙烯高分子材料是加聚反应,符合要求,故A正确;
B.甲烷与氯气制备一氯甲烷,属于取代反应,伴随很大副反应,反应物没全部转化为所需产物,故B错误;
C.用苯和浓硫酸、浓硝酸为原料制取硝基苯属于取代反应,反应物没全部转化为所需产物,故C错误;
D.用石灰石和稀盐酸反应制得二氧化碳,属于复分解反应,反应物没全部转化为所需产物,故D错误;
故选A.
点评 本题考查原子经济与化学反应类型的关系,明确各种反应的特点是解题关键,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
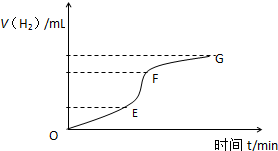 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应利用了Cl2的强氧化性 | B. | 若管道漏气遇氨就会产生白烟 | ||
| C. | 该反应属于复分解反应 | D. | 生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油 | |
| B. | 鉴别蚕丝和人造丝(纤维素)的方法之一是灼烧,有烧焦羽毛气味的是蚕丝 | |
| C. | 农村兴建沼气池将秸秆发酵产生沼气,可减少因焚烧带来的环境污染 | |
| D. | 氮、磷是作物生长的重要元素,故含氮、磷的废水可直接排放到湖泊中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B可形成AB32-、A2B42-等离子 | |
| B. | B的氢化物的沸点低于C的氢化物的沸点 | |
| C. | 单质C的晶体中含有共价键和范德华力 | |
| D. | 由A、D形成的一种物质可用以提取碘水中碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com