

| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
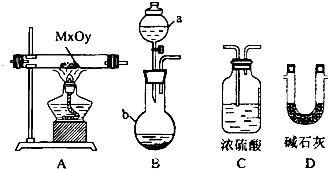
分析 制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气.
(1)二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水;在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;
(2)C装置中浓硫酸干燥氯气;D中石英砂中的铁、铝等杂质也能转化为相应氯化物;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液(或溴水)褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3.
解答 解:(1)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO;
(2)C装置中浓硫酸干燥氯气,D中石英砂中的铁、铝等杂质也能转化为相应氯化物,D、E间导管短且粗防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管,
故答案为:浓硫酸;防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,故答案为:只有ClO-;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
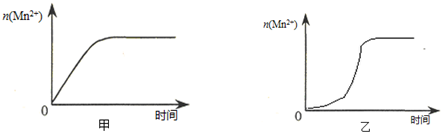
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
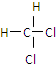 和
和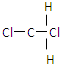
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com