
【题目】用系统命法写出下列物质名称:
(1)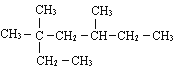 _______________;
_______________;
(2)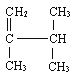 _______________;
_______________;
(3)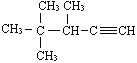 的系统名称为_______________;
的系统名称为_______________;
(4)键线式![]() 表示的分子式_______________;名称是_______________。
表示的分子式_______________;名称是_______________。
科目:高中化学 来源: 题型:
【题目】回答下列问题
(I)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③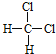 和
和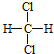
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
(1)属于同系物的是________,属于同位素的是________,属于同分异构体的是________,属于同素异形体的是______,属于同种物质的是________。
(II)请认真观察如图,然后回答问题.
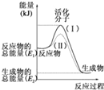
(2)如图中所示反应是______(填“吸热”或“放热”)反应。
(3)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会___(填“放出”或“吸收”)___kJ的热量。
(4)下列反应中,属于吸热反应的是_____。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
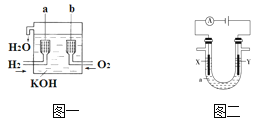
(1)a电极反应式是_______________________;
(2)该燃料电池生成了360 kg的水,则电路中通过了_____________mol的电子。
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极反应式是___________________。
②Y电极的材料是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据氧化还原反应2Ag+(ag)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
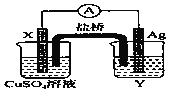
电极X的材料是_______;电解质溶液Y是_________________;银电极为电池的________极,发生的电极反应为______________________;X电极上发生的电极反应为______________________。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为氢氧燃料电池,
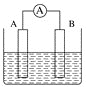
写出A电极反应式:___________________________________;写出B电极反应式:_______________________;写出该电池反应:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是近年来我国化石燃料和其他能源的消耗构成示意图,下列说法正确的是( )
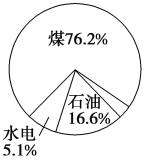
A. 当今人类所需的能量绝大部分是由化学反应产生的
B. 煤、石油、天然气的成分都是烃
C. 为消除温室效应,应禁用煤、石油、天然气等含碳能源
D. 核能、氢能、太阳能是当今社会的主要能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 把煤隔绝空气加强热使之分解的过程叫干馏
B. 煤的干馏包含着物理变化和化学变化
C. 煤中含有大量苯和甲苯,可以用先干馏后分馏的方法将其分离开
D. 以煤为主要原料,可以合成甲醇等液体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
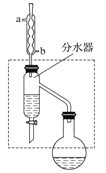
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯(CH3COOCH2CH2CH2CH3)的反应装置示意图和有关信息如下:
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式_________。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是_____________。(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。①正确的操作步骤是________________(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是_________。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:
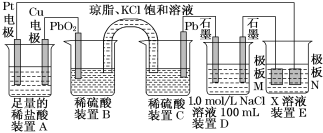
(1)装置B中PbO2上发生的电极反应方程式为________________
(2)装置A中总反应的离子方程式为_____________________________。
(3)若装置E中的目的是在Cu材料上镀银,则X为________,极板N的材料为________。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________L(标准状况下)。
(5)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。
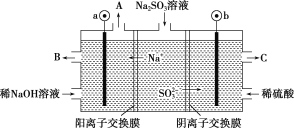
①图中a极连接电源的___________极,
②b极电极反应式为____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com