
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
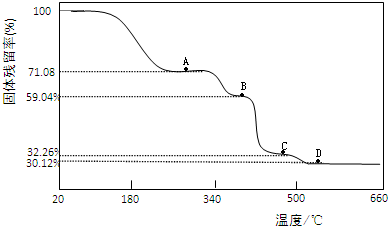
| 2×1+1×2 |
| 2 |
| ||
| ||
| 177 |
| 177+18n |
| 71.08 |
| 100 |
| 59.04 |
| 100 |
| MrB |
| 249 |
| 32.26 |
| 100 |
| MrC |
| 249 |
| ||
| 30.12 |
| 100 |
| MrD |
| 249 |


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| A、乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 |
| B、sp3杂化轨道是由能量相近1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 |
| C、凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 |
| D、氨气分子中有一对未参与杂化的孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-40℃NH4F-100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 | 33.3 | 37.2 | 41.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
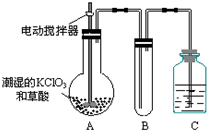 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别AlCl3、MgCl2两种溶液 |
| B、将FeCl3溶液蒸干制备FeCl3固体 |
| C、酒精可将溴水中的溴萃取出来 |
| D、利用是否有丁达尔现象可以区别溶液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com