
【题目】(1)在一定条件下,28.80g金属单质A与1.20molCl2完成反应,生成1.20molAClx,则x=__________,若A原子核内质子数等于中子数,则A原子核内中子数为__________ ,氯原子结构示意图为____________。
(2)现有氨气3.4g,在标准状况下其体积为____________,含有氮原子的数目为_____ ;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度为______________。
【答案】2 12 ![]() 4.48L 1.204×1023(或0.2NA) 0.4mol/L
4.48L 1.204×1023(或0.2NA) 0.4mol/L
【解析】
(1)根据Cl元素守恒,确定化学式AClx中X的值,然后根据A守恒确定A的相对原子质量,再结合相对原子质量等于质子数与中子数的和确定A原子核内的中子数,Cl是17号元素,原子核外电子分层排布,书写氯原子结构示意图;
(2)根据n=![]() 及n=
及n=![]() 计算3.4g氨气在标准状况下其体积,根据NH3中含有的N原子数及NH3的物质的量计算含有氮原子的数目;根据c=
计算3.4g氨气在标准状况下其体积,根据NH3中含有的N原子数及NH3的物质的量计算含有氮原子的数目;根据c=![]() ,计算将这些气体全部溶于水,配成500mL溶液,所得溶液的物质的量浓度。
,计算将这些气体全部溶于水,配成500mL溶液,所得溶液的物质的量浓度。
(1)1.20molCl2与28.80gA完成反应,生成1.20molAClx,根据Cl原子守恒可得1.20mol×2=1.20xmol,解得x=2;根据A原子守恒可知28.80g金属单质A的物质的量是1.20mol,则A的摩尔质量M=28.80g÷1.20mol=24g/mol,则A的相对原子质量是24,若A原子核内质子数等于中子数,则A原子核内中子数为24÷2=12;Cl是17号元素,核外电子排布是2、8、7,所以氯原子结构示意图为![]() ;
;
(2)3.4g氨气的物质的量n=![]() =0.2mol,则根据n=
=0.2mol,则根据n=![]() 可知该气体在标准状况下其体积V=n·Vm=0.2mol×22.4L/mol=4.48L;在1个NH3中含有1个N原子,则在0.2mol NH3中含有氮原子的数目为N=0.2mol×NA/mol=0.2NA;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度c=
可知该气体在标准状况下其体积V=n·Vm=0.2mol×22.4L/mol=4.48L;在1个NH3中含有1个N原子,则在0.2mol NH3中含有氮原子的数目为N=0.2mol×NA/mol=0.2NA;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度c=![]() =0.4mol/L。
=0.4mol/L。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
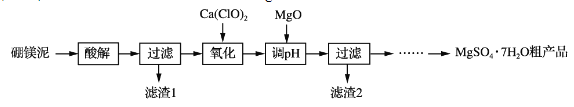
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、![]() 、酒精、NaCl溶液,振荡后静置,现象正确的是
、酒精、NaCl溶液,振荡后静置,现象正确的是![]()
![]()
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、![]() 、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )

A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,还原产物是![]()
C. 配平后氧化剂与还原剂的化学计量数之比为4∶1
D. ClO-发生还原反应,表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制乙烯(A)、硝基苯(B)和石油分馏(C)的装置:
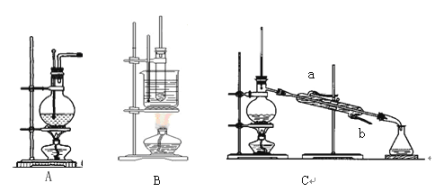
(1)写出制取乙烯、硝基苯的化学方程式:___________、_________。
(2)在A和 C实验中需加碎瓷片,其目的是_______________。
(3)分离试验B中硝基苯的方法是__________。
(4)在石油分馏实验中,冷凝水的流向应是_______进______出(填字母a、b)。
(5)实验室制乙烯时,常伴随有刺激性气味的气体产生,为消除其对乙烯性质实验的干扰,可将气体通过_______溶液除去。若反应没有及时升温至170℃,可能带来的主要副产物是____(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。
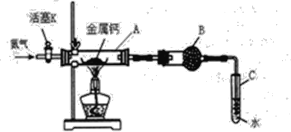
(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯在催化剂的作用下可发生氧化反应,其反应机理为:PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO,Pd+2CuCl2 PdCl2+2CuCl,4CuCl+4HCl+O2 4CuCl2+2H2O,下列说法错误的是
Pd+2HCl+CH3CHO,Pd+2CuCl2 PdCl2+2CuCl,4CuCl+4HCl+O2 4CuCl2+2H2O,下列说法错误的是
A. 催化剂加快反应速率的原理是通过改变反应路径降低了活化能
B. 该催化氧化反应的总方程式是2C2H4+O2![]() 2CH3CHO
2CH3CHO
C. 该催化氧化过程可在无水条件下进行
D. CuCl2和PdCl2的混合溶液可作为该反应的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com