
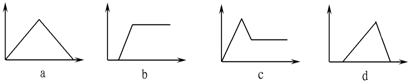
 ,选项中没有图象符合;
,选项中没有图象符合; ,故选b符合;
,故选b符合; ,图象c符合;
,图象c符合; ,图象a符合;
,图象a符合;

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
| 组别 | 分类标准 | 不属于该类别的物质 |
| 第①组 | H2 | |
| 气体 | ||
| 第②组 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓)
2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O O2(g)=Cu2O(s);△H1=-12.0kJ/mol
O2(g)=Cu2O(s);△H1=-12.0kJ/mol □CuSO4+□Cu(NO3)2+□NO↑+□______
□CuSO4+□Cu(NO3)2+□NO↑+□______查看答案和解析>>
科目:高中化学 来源: 题型:单选题
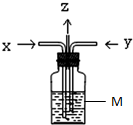 如图,木炭与浓硫酸共热产生的气体x和铜跟浓硝酸反应产生的气体y同时通入盛有过量M的洗气瓶中,下列说法正确的是
如图,木炭与浓硫酸共热产生的气体x和铜跟浓硝酸反应产生的气体y同时通入盛有过量M的洗气瓶中,下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com