


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、NH4HCO3
| ||||
| B、Na2O+H2O═2NaOH | ||||
| C、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O | ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
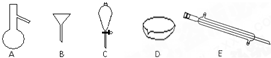
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
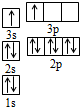 有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑥ | B、①③⑥ |
| C、③④⑥⑦ | D、②③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com