
����Ŀ���йذ���ʵ������ȡ������ʵ�����£�
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ____________________________����֤�����Ƿ��ռ����ķ�����________________________��
��2����ͼ��ʵ���ҽ��а�������ˮ����Ȫʵ��װ�ã����������������________��


A����ʵ��˵��������һ�ּ�������ˮ������
B��������ƿ�е�Һ����ɫ����ɫ��Ϊ��ɫ��˵����ˮ�ʼ���
C���γ���Ȫ��ԭ���ǰ�������ˮ����ƿ�ڵ���ѹС�ڴ���ѹ
D�����������氱�������ô�װ��Ҳ�ɽ�����Ȫʵ��
��3������İ����ڸ������ܱ�����ͭ�������������ֵ��ʺ�һ�ֻ������Ӧ�Ļ�ѧ����ʽ��___________________________________��
��4��д��Cu��Ũ�����ڼ��������·�Ӧ�Ļ�ѧ����ʽ_____________________________
���𰸡� 2NH4Cl+Ca��OH��2![]() CaCl2+2NH3��+2H2O ��ʪ��ĺ�ɫʯ����ֽ�ӽ�����ƿ�ڣ�����ֽ����ɫ��������պ��Ũ����IJ������ӽ�����ƿ�ڣ����а������ɣ�����֤���������ռ����� D 2NH3+3CuO
CaCl2+2NH3��+2H2O ��ʪ��ĺ�ɫʯ����ֽ�ӽ�����ƿ�ڣ�����ֽ����ɫ��������պ��Ũ����IJ������ӽ�����ƿ�ڣ����а������ɣ�����֤���������ռ����� D 2NH3+3CuO![]() N2+3Cu+3H2O�� Cu+2H2SO4(Ũ)
N2+3Cu+3H2O�� Cu+2H2SO4(Ũ) ![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
��������(1)ʵ�����ù����Ȼ�狀��������ƻ�ϼ�����ȡ��������Ӧ�Ļ�ѧ����ʽΪ2NH4Cl+ Ca(OH)2![]() CaCl2+2NH3��+2H2O����֤�����Ƿ��ռ����ķ�������ʪ��ĺ�ɫʯ����ֽ�ӽ�����ƿ�ڣ�����ֽ����ɫ������������Ũ����IJ������ӽ�����ƿ�ڣ����а������ɣ�����֤���������ռ����ˡ�
CaCl2+2NH3��+2H2O����֤�����Ƿ��ռ����ķ�������ʪ��ĺ�ɫʯ����ֽ�ӽ�����ƿ�ڣ�����ֽ����ɫ������������Ũ����IJ������ӽ�����ƿ�ڣ����а������ɣ�����֤���������ռ����ˡ�
(2)A����������ˮ����Ȫʵ��֤��������һ�ּ�������ˮ�����壬��A��ȷ��B���ɷ�ӦNH3��H2O![]() NH3��H2O
NH3��H2O![]() NH4����OH����֪�����з�̪��ˮ������ƿ��Һ�����ɫ����ɫ��Ϊ��ɫ��֤����ˮ��Һ�ʼ��ԣ���B��ȷ��C����������ˮ����ƿ����ѹ��С�����ڴ���ѹ�����ã��ձ��е�ˮ������ƿ�γ���Ȫ������C��ȷ��D�����������ܽ��С������ˮ����ƿ����ѹ�仯�������Բ������ô�װ�ý�����Ȫʵ�飬����D������ȷ��ΪD��
NH4����OH����֪�����з�̪��ˮ������ƿ��Һ�����ɫ����ɫ��Ϊ��ɫ��֤����ˮ��Һ�ʼ��ԣ���B��ȷ��C����������ˮ����ƿ����ѹ��С�����ڴ���ѹ�����ã��ձ��е�ˮ������ƿ�γ���Ȫ������C��ȷ��D�����������ܽ��С������ˮ����ƿ����ѹ�仯�������Բ������ô�װ�ý�����Ȫʵ�飬����D������ȷ��ΪD��
(3)���������֪�������ڸ������ܱ�����ͭ��������ͭ�Ļ��ϼ۽���ֻ������ͭ���ʣ�NH3��NԪ�صĻ��ϼ����ߣ�������N2�����Ի�����һ����ˮ����Ӧ�Ļ�ѧ����ʽΪ2NH3+ 3CuO ![]() N2+3Cu+3H2O��
N2+3Cu+3H2O��
(4) Cu��Ũ�����ڼ��������·�Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4(Ũ) ![]() CuSO4+SO2�� +2H2O
CuSO4+SO2�� +2H2O


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���û���Ӧ�õ�����������
A. Na��FeSO4��Һ���»�� B. COͨ�����ȵ�Fe2O3
C. H2ͨ��FeSO4��Һ D. Al��Fe3O4��ϼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ�����漰�ı仯�У��й��ܲ������ǣ� ��
A.Ũ��������ˮB.�кͷ�ӦC.����ӷ�D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס���������ϡ��Һ����ü�pH=a���ҵ�pH=a+1�������ƶ�����ȷ���ǣ� ��
A.���ʵ���Ũ��c���ף�=10c���ң�
B.������ˮ���������H+�����ʵ���Ũ�Ⱥ��ҵ����
C.�к͵����ʵ���Ũ�ȵ������NaOH��Һ��ס�����������V���ң���10V���ף�
D.���е�c��OH����Ϊ����c��OH������10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ̼��ƵĴ��ȣ��躬����SiO2����ij��ȤС���ͬѧ��������¼���ʵ�鷽����������
�ٳ�ȡ̼�����ƷM g
����c1mol/L������V1 mL���������ܽ���Ʒ
��ȡ�ܽ�����Һ�����ʮ��֮һ����c2 mol/L��NaOH��Һ�ζ���ǡ��ȥV2 mL��
������
�ٳ�ȡ̼�����ƷM g
�ڸ�������ֱ���������ٸı䣬��ȴ�������ʣ���������ΪM1g
������
�ٳ�ȡ̼�����ƷM g
�ڼ�������c mol/L������V mLʹ֮��ȫ�ܽ�
�۹��˲�ȡ��Һ
������Һ�м������c1 mol/L��Na2CO3��ҺV1 mL
�ݽ�������еij����˳���ϴ�ӡ�������أ�����ΪM1g��
��������ʵ�鷽�����ش��������⣺
��1���������м���̼��ƴ��ȵĹ�ʽΪ ��
��2���������еġ���ȴ��Ӧ��β������������� ��
��3���������в���Ҫ������������ѡ���ţ���
A.c��V
B.c1��V1
C.M1
D.M
��4����������Ϊ�˼���ʵ������Ҫ�IJ���������ѡ���ţ���
A.��ȷ�ⶨNa2CO3��Һ�����V1 mL
B.��ȷ����Na2CO3��Һ��ʹ��Ũ��Ϊc1 mol/L
C.����������ó���ϴ�ӣ�ϴ��Һ�������
��5���������һ��ʵ�鷽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �����ʵĽǶȷ��࣬SO2��������������
B. �ӶԴ���������Ӱ��ĽǶȣ�SO2��һ�ִ�����Ⱦ��
C. ����ˮ���Ƿ�������ĽǶȣ�SO2���ڵ����
D. ��Ԫ�ػ��ϼ۵ĽǶȷ��࣬SO2�������������ֿ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������X��һ����Ҫ���л�����ԭ�ϣ�����ʽC7H8 �� ������Ϊ��ʼԭ����Ƴ���ͼת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ��������A��һ�ȴ��F�ķ���ʽΪC7H7NO2 �� Y��һ�ֹ��ܸ߷��Ӳ��ϣ�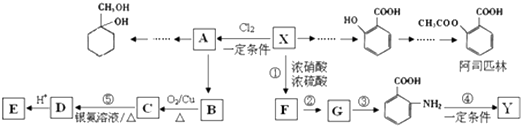
��֪������Ϣ��
��������ڸ�����ص������£��������������Ȼ� ![]()
�� ![]() ���������ױ�������
���������ױ�������
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X�Ľṹ��ʽ�� �� ��˴Ź�������ͼ�������շ壻
��2���л���C�Ľṹ��ʽ����
��3����˾ƥ�ַ����к��еĹ����ŵ���������1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊmol��
��4��Y�Ľṹ��ʽΪ��
��5��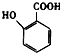 �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ���֣�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ���֣�
��6����������A���������ʺϳ� 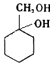 �����̣�A
�����̣�A ![]() �ס���
�ס��� ![]()
![]()
![]()
![]() �ס��ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
�ס��ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��Ӧ2A��g��B��g��+C��g��������v��A���仯��ͼ����������������ǣ� ��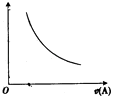
A.�¶�
B.ѹǿ
C.A��Ũ��
D.��Ӧʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CaSO4���ȷֽ⣬���������¶Ȳ�ͬ������ɷ�Ҳ��ͬ������ɷֿ���ΪSO2��SO3��O2�е�һ�֡����ֻ����֣�ij��ѧ����С����ͨ��ϵ��ʵ��̽��CaSO4�ֽ����ɵ����壬����ȷ��CaSO4�ֽ�Ļ�ѧ����ʽ��
��1��[�������]����������ijɷֿ���ֻ��SO3һ�֣�
����������ijɷֿ��ܺ������֣��������ʽ��
��2������������ijɷֿ��ܺ��� SO2��SO3��O2���֣�[���ʵ��]
�û�ѧ����С����ͨ���ⶨDװ�õ������Լ���Ͳ��ˮ���������̽��CaSO4�ֽ����ɵ�����ɷ֣�����ȷ��CaSO4�ֽ�Ļ�ѧ����ʽ��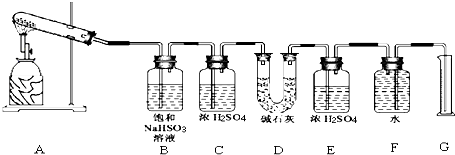
[ʵ�����]
��������ʵ�鷽���������飮��֪ʵ�����ʱ��CaSO4��ȫ�ֽ⣮
��������ʵ������ͼ�¼��ʵ�����ݽ��з�����
����ʵ�����ʱ��G����Ͳû���ռ���ˮ����֤��������ȷ�����������
����ʵ�����ʱ��װ��D�����������ӣ��ܷ�϶����������һ������SO2������SO3����˵�����ɣ� ��
�۸�ʵ������У������ⶨ�����ϴ����������� ��
��д��һ�ּ��ɣ�
�ܾ��Ľ���������ͬѧ���и�ʵ�飬���ڼ���ʱ���¶Ȳ�ͬ��ʵ��������Ҳ��ͬ��
����������£�
ʵ��С�� | ��ȡCaSO4 | װ��D���� | ��ȡ���������װ�ò������������ ������ɱ�״�������������� ��mL�� |
һ | 4.08 | 2.56 | 224 |
�� | 5.44 | 2.56 | 448 |
��ͨ�����㣬�ƶϵڶ���ͬѧ�ó���CaSO4�ֽ�Ļ�ѧ��Ӧ����ʽ��
�ڶ��飺 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com