
【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
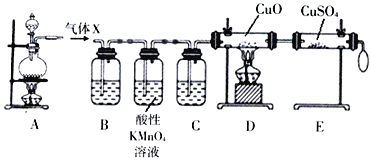
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
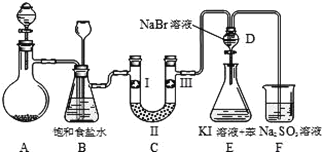
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【答案】二氧化硫、氢气 除去气体中残余的二氧化硫 黑色粉末变红色 白色粉末变蓝色 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O d
【解析】
Ⅰ.(1)根据元素分析;
(2)根据二氧化硫的性质选择检验试剂;检验氢气之前需要除去二氧化硫;
(3)氢气与氧化铜反应生成铜单质和水,据此分析;
Ⅱ.在装置A中用高锰酸钾固体与浓盐酸反应制取Cl2;用装置B除去氯气中的杂质HCl,在装置C验证氯气是否具有漂白性,在装置D中验证Cl2与NaBr的反应,在装置E中验证KI是否发生反应,在装置F中用Na2SO3吸收尾气中的氧化性气体。
I.(1)将一定量的浓H2SO4与足量Zn置于装置A中充分反应,开始反应产生硫酸锌、二氧化硫和水;随着反应的进行,硫酸变为稀硫酸,这时Zn与稀硫酸反应产生硫酸锌和氢气,反应都是放热反应,因此生成的气体X中有水蒸气,还可能含有二氧化硫、氢气;
(2)装置B检验二氧化硫,二氧化硫具有漂白性、还原性,因此可以选择品红溶液、酸性高锰酸钾溶液(溴水)作为检验试剂;检验氢气的生成之前,应先排除二氧化硫的干扰,因此用酸性高锰酸钾除去气体中残余的二氧化硫;
(3) D、E装置用于证明气体X中的另一种组分,该组分是H2,在D装置中H2与CuO反应产生Cu单质和H2O,固体由黑色变为红色;产生的水蒸气进入E装置,与无水硫酸铜反应变为硫酸铜晶体,固体的颜色由白色变为蓝色,所以D、E装置观察到的实验现象分别是黑色粉末变红色、白色粉末变蓝色;
II. (1)实验室也可用KMnO4与浓盐酸混合发生氧化还原反应制取氯气,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,根据图示装置可知,II中应该为固体干燥剂,氯气干燥后再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故合理选项是d。


科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )

A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为: CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
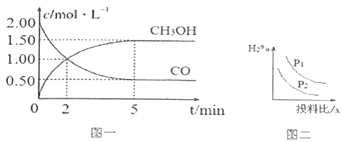
①反应2min到5min,用氢气表示的平均反应速率v(H2)=___________。
②下列说法正确的是______________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高 CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是:______(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3molCH3OH(g),则此平衡将______________移动。(填“向正反应方向”、“不”或“向逆反应方向”)
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,己知:CH3OH、H2的燃烧热(ΔH)分别为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH(l)和H2O(l)的热化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是 ( )
A.生成白色沉淀
B.既有气泡产生,又生成红褐色沉淀
C.既有气泡产生,又生成白色沉淀
D.有气泡产生,无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明氯的非金属性比硫强的事实是( )
A. 氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢
B. 向硫化氢的水溶液中通入氯气可得到淡黄色的硫
C. 氯气能与水反应而硫不能
D. 氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g) ![]() qZ(g) ,△H<0,m+n>q在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g) ,△H<0,m+n>q在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,X正反应速率增大
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,X的正反应速率变小, Y的逆反应速率增大
D. 增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下能实现转化的是
①Si![]() Na2SiO3(aq)
Na2SiO3(aq)![]() H2SiO3
H2SiO3
②Na![]() Na2O2
Na2O2![]() NaOH
NaOH
③CaCO3![]() CaO
CaO![]() CaC2
CaC2![]() C2H4
C2H4
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤MgCl2(aq)![]() MgCl2·6H2O
MgCl2·6H2O![]() Mg
Mg
⑥CuSO4(aq)![]() Cu(OH)2
Cu(OH)2![]() Cu2O
Cu2O
A. ①④⑥ B. ③④⑤
C. ②⑤⑥ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com