
【题目】已知反应mX(g)+nY(g) ![]() qZ(g) ,△H<0,m+n>q在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g) ,△H<0,m+n>q在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,X正反应速率增大
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,X的正反应速率变小, Y的逆反应速率增大
D. 增加X的物质的量,Y的转化率降低
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是
A. 检验亚硫酸钠试样是否变质:
![]()
B. 除去粗盐中含有的硫酸钙杂质:
![]()
C. 检验某溶液中是否含有![]() :
:
![]()
D. 证明酸性条件下![]() 的氧化性比
的氧化性比![]() 强
强
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
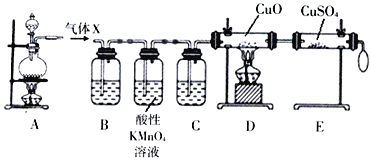
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
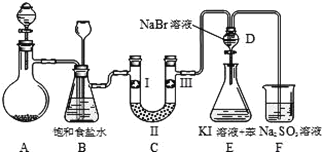
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是( )
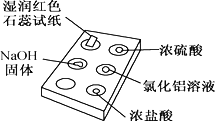
选项 | 实验现象 | 解释 |
A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓ |
D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl=NH4Cl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
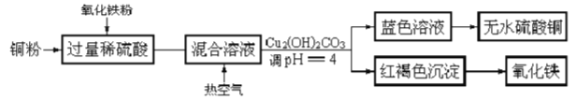
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如上图所示:稀硫酸和氧化铁反应的离子方程式是_________________________;铜和上述反应得到的物质反应的离子方程式是_______________;向混合溶液中通入热空气的反应的离子方程式是____________________;分离蓝色滤液和红褐色沉淀的实验操作是_____________________。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:
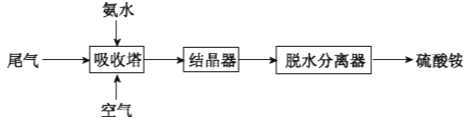
①吸收塔中发生反应的化学方程式是_________。
②检验硫酸铵中的NH4+的操作是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中含镁元素的反应物作还原剂的是( )
A.MgCO3=MgO+CO2↑
B.Mg(OH)2+2H+=Mg2++2H2O
C.Mg+2HCl=MgCl2+H2↑
D.Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据元素周期表和元素周期律得出的推断中正确的是( )
A. ![]() 与
与![]() 得电子能力相同
得电子能力相同
B. 由于HCl水溶液的酸性强于H2S水溶液的酸性,因此氯的非金属性强于硫
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 金属元素原子最外层电子数越少,该金属失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2的电子式是________。
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g)+H2 (g)![]() CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH(g)的热化学方程式是________。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。

(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“I”“II”或“III”)。
②T3时,反应I的v(正)________v(逆)(填“>”“<”或“=”)。
③温度为T5时,该反应的平衡常数K=________。
(4)甲醇合成甲醚的反应为2CH3OH(g)![]() CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)![]() C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:

①反应速率较快的是________(填“Ⅰ”或“Ⅱ”),原因是________。
②根据反应原理,分析增大压强对合成甲醚的影响________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com