
【题目】下列各组物质,按单质、化合物、混合物顺序排列的是
A.铜、水银、陈醋B.白磷、生石灰、熟石灰
C.液氧、烧碱、啤酒D.干冰、纯碱、碘伏
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但CO2作为一种资源,开发和利用的前景十分诱人。
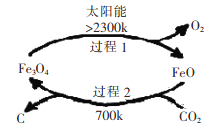
I、利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为:__________。
II、近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应制取甲醇。其工艺流程如图所示:

(1)①由吸收池导入分解池中的主要物质的化学式是____________。
②上述流程中____________(填化学式)可循环使用,该流程体现了“绿色化学”理念。
(2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示:

①合成塔中发生的化学反应方程式为____________。
②T1时a点v(正)____________v(逆)(填“>”,“<”,“=”)
③计算温度为T4时b的平衡常数为____________。
(3)为检验吸收池中饱和K2CO3溶液是否充足,量取l00mL吸收液用0.10 mol./L盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸)变化关系如图所示:

则该l00mL吸收液还可吸收标准状况下_______mLCO2.
III、以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如右图所示。

(1)H+的移动方向是_______________(填从左至右或从右至左);
(2)产生乙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某lL混合溶液中所含离子的个数比如下表,则M离子可能为( )
所含离子 | NO3- | SO42- | H+ | M |
个数比 | 2 | 1 | 2 | 1 |
A.Mg2+B.Ba2+C.F-D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6。其流程如下:

已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是________、__________。反应设备不能用玻璃材质的原因是______________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的____________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:________________。
(3)第④步分离采用的方法是_____________;第⑤步分离尾气中HF、HC1采用的方法是____________。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为__________mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )
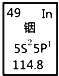
A. 铟元素的质量数是114.8
B. 铟元素的相对原子质量是114
C. 铟元素是一种副族元素
D. 铟原子核外有49个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用天然气的主要成分是烷烃,其中甲烷(CH4)占绝大多数,已知氧气约占空气体积的20%,出现燃气泄漏时如果遇到火花会引起爆炸,当泄漏的甲烷与空气体积比为1:10时,爆炸最剧烈,此时甲烷与氧气的质量比约为
A.1:2B.2:1C.1:4D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaCl3+6NH4HCO3= La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(1)盛放稀盐酸的仪器为__________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→ → → → → 。_____________
(3)Y中发生反应的化学反应式为____________________________________。
(4)X中盛放的试剂是____________,其作用为___________________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________________________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La 3++H2Y2-= LaY-+2H+),消耗EDTA溶液44.0 mL。则产品中La2(CO3)3的质量分数w[La2(CO3)3]=________________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为__________;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示。在t1 min之后固体质量增加的原因可能是_______________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于可逆反应的是( )
A.Pb+PbO2+4H++2SO42﹣ ![]() 2PbSO4+2H2O
2PbSO4+2H2O
B.2SO2+O2 ![]() 2SO3
2SO3
C.Cl2+H2O?HCl+HClO
D.2NO2?N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com