
����Ŀ��CO2��ȼ�պʹ�л�����ղ��Ҳ���������ЧӦ�ķ�������CO2��Ϊһ����Դ�����������õ�ǰ��ʮ�����ˡ�
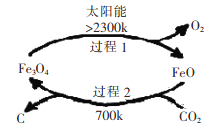
I������̫���ܣ���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ������2�Ļ�ѧ����ʽΪ��__________��
II�������ѧ���������ɫ���������롣�Ѻ��д���CO2�Ŀ�������K2CO3��Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��H2��Ӧ��ȡ�״����乤��������ͼ��ʾ��

��1���������ճص���ֽ���е���Ҫ���ʵĻ�ѧʽ��____________��
������������____________���ѧʽ����ѭ��ʹ�ã�����������������ɫ��ѧ�����
��2����ͬ�¶��£���1L�����ܱ������г���2mol CO2��5 mol H2����ͬʱ���ڲ��CO2��ת�������¶ȱ仯����ͼ��ʾ��

�ٺϳ����з����Ļ�ѧ��Ӧ����ʽΪ____________��
��T1ʱa��v������____________v���棩������>������<������=����
�ۼ����¶�ΪT4ʱb��ƽ�ⳣ��Ϊ____________��
��3��Ϊ�������ճ��б���K2CO3��Һ�Ƿ���㣬��ȡl00mL����Һ��0.10 mol./L����ζ������ɵ�V(CO2)����״���£���V�����ᣩ�仯��ϵ��ͼ��ʾ��

���l00mL����Һ�������ձ�״����_______mLCO2.
III����ϡ����Ϊ�������Һ�����Բ���Ϊ�缫������̫���ܽ�CO2ת��Ϊ��̼ϩ��������ԭ������ͼ��ʾ��

��1��H+���ƶ�������_______________����������һ����������
��2��������ϩ�ĵ缫��ӦʽΪ_______________��
���𰸡� 6FeO+CO2![]() C+2 Fe3O4 KHCO3 K2CO3 CO2+3H2
C+2 Fe3O4 KHCO3 K2CO3 CO2+3H2![]() CH3OH+ H2O > 800 56 �������� 2CO2+12H++ 12e-=C2H4+4H2O
CH3OH+ H2O > 800 56 �������� 2CO2+12H++ 12e-=C2H4+4H2O
��������������Ҫ�����йض�����̼�����ʡ�
I������2�Ļ�ѧ����ʽΪ��6FeO+CO2![]() C+2Fe3O4��
C+2Fe3O4��
II����1���ٷֽ���в���CO2�������ճص���ֽ���е���Ҫ���ʵĻ�ѧʽ��KHCO3��
������������KHCO3�ֽ����K2CO3������K2CO3���ѧʽ����ѭ��ʹ�ã�����������������ɫ��ѧ�����
��2���ٺϳ����з�����Ӧ�Ļ�ѧ����ʽΪCO2+3H2![]() CH3OH+H2O��
CH3OH+H2O��
��T1ʱa��ƽ����������Ӧ������������v������>v���棩��
���¶�ΪT4ʱb���ƽ��Ũ�ȣ�c(CO2)=(2-1.6)mol/L=0.4mol/L��c(H2)=(5-4.8)mol/L=0.2mol/L��c(CH3OH)=c(H2O)=1.6mol/L��ƽ�ⳣ��Ϊ![]() =800��
=800��
��3��V(����)��25mLʱ,������Ӧ��K2CO3+HCl![]() KCl+KHCO3��n(K2CO3)= n(HCl)=0.10mol/L��25mL=2.5mmol��K2CO3+H2O+CO2
KCl+KHCO3��n(K2CO3)= n(HCl)=0.10mol/L��25mL=2.5mmol��K2CO3+H2O+CO2![]() 2KHCO3,���l00mL����Һ��������2.5mmol����״����56mLCO2.
2KHCO3,���l00mL����Һ��������2.5mmol����״����56mLCO2.
III�� ��1��CO2������ԭ��Ӧ��ͨ��CO2��һ��������������������������H+���ƶ������Ǵ���������
��2��������ϩ�ĵ缫��ӦʽΪ2CO2+12H++12e-=C2H4+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2) ����������(SOCl2) ������Ҫ�Ļ����Լ�����ˮ�������ҷ�Ӧ����������ˮ����
��֪:��SO2Cl2 (g)![]() SO2(g)+Cl2(g) ��H= +471.7kJ/mol; ƽ�ⳣ��K1
SO2(g)+Cl2(g) ��H= +471.7kJ/mol; ƽ�ⳣ��K1
��SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) ��H=-477.3kJ/mol; ƽ�ⳣ�� K2
2SOCl2(g) ��H=-477.3kJ/mol; ƽ�ⳣ�� K2
��1����Ӧ2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)��ƽ�ⳣ��K=_____(��K1��K2��ʾ) �÷�Ӧ��H=_____kJ/mol��
SO2Cl2(g)+SCl2(g)��ƽ�ⳣ��K=_____(��K1��K2��ʾ) �÷�Ӧ��H=_____kJ/mol��
��2�����ھ��ȡ����ݵ��ܱ������У�Ͷ��һ������SO2Cl2(g)��SCl2(g)��������ӦSO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����____(�����)��
2SOCl2(g)������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����____(�����)��

��3��Ϊ�о���ͬ�����Է�Ӧ�ٵ�Ӱ�죬�ں��������£���2L�����ܱ������м���0.2molSO2Cl2��10min��Ӧ�ٴﵽƽ�⡣���10min��v(SO2)= 8.0��10-3mo1��L-1��min-1����ƽ��ʱSO2Cl2��ת���ʦ�1=_______���������������ֲ��䣬��Ӧ���ں�ѹ�����½��У�ƽ��ʱSO2Cl2��ת���ʦ�2_____��1���>������<����=��������Ҫ����SO2Cl2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��______(�о�һ��)��
��4�����������(Li/SOCl2) �����һ�ִ�������أ��õ�������ʯī���缫���ϣ��������Һ�������Ȼ����(LiAlCl4) �ܽ�����������(SOCl2)���γɵģ������ܷ�Ӧ����ʽΪ:8Li+3SOCl2��6LiCl+Li2SO3+2S��
��д����ع���ʱ�����ĵ缫��Ӧʽ_____________��
�����ô˵������Դ���Բ����缫���200mL 0.2mol.L-1CuSO4��Һ����������������״����896mL������ʱ����ظ�������﮵�������______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ��H=-53.7kJ/mol����2L ���ݺ����ܱ������г���1mol CO2��2.8molH2��Ӧ��ͼ�й���I�����������ֲ�ͬ���������½���ƽ��Ĺ�����CO2��ת����[��(CO2)]��ʱ��(t)�ı仯���ߡ�����˵������ȷ����
H2O(g)+CH3OH(g) ��H=-53.7kJ/mol����2L ���ݺ����ܱ������г���1mol CO2��2.8molH2��Ӧ��ͼ�й���I�����������ֲ�ͬ���������½���ƽ��Ĺ�����CO2��ת����[��(CO2)]��ʱ��(t)�ı仯���ߡ�����˵������ȷ����

A. m��:v(��)>v(��)
B. ��ܣ����̢�>����I
C. n��ʱ�÷�Ӧ��ƽ�ⳣ��K��50
D. ����I��t2ʱ�̸ı�ķ�Ӧ���������������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ,����˵����ȷ���ǡ�(�� )
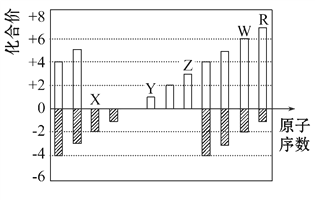
A. ԭ�Ӱ뾶:Z>Y>X
B. ��̬�⻯����ȶ���: W>R
C. WX3��ˮ��Ӧ�γɵĻ��������H2WO3
D. Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��NaCl��MgSO4���ܽ�����ߣ�����˵����ȷ���ǣ� �� 
A.ֻ����t1��ʱ��NaCl��MgSO4���ܽ�Ȳ����
B.t1�桫t2�棬MgSO4���ܽ�����¶����߶���С
C.��t2��ʱ��MgSO4������Һ�����������������
D.��MgSO4������Һ���¶ȴ�t3�潵��t2��ʱ���о�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������98%��ŨH2SO4����=1.84g/cm3�����Ƴ�0.5mol/L��ϡH2SO4 500mL�IJ������밴Ҫ����գ� ��i������ŨH2SO4�����Ϊ������һС���������ȡ����
��ii�����ʵ������15mL��20mL��50mL��Ͳ��Ӧѡ��mL��Ͳ��ã�
��iii������ȡ��ŨH2SO4���ձ��ڱ�����ע��ʢ��Լ100mLˮ���ձ�������Ͻ��裮
��iv������������Һ�ز�����ע���У�����50mL����ˮϴ���ձ�2��3�Σ�ϴ��ҺҪע�����������У���ҡ�ȣ�
��v����ˮ����̶���1��2cmʱ��������ˮ��ʹ��Һ��Һ����̶���ƽ��
��vi���á�ƫ�ߡ���ƫ�͡�����Ӱ�족��գ�
�ٶ���ʱ���۲�Һ�温�ӣ���
��ҡ�Ⱥ�Һ����ڿ̶��ߣ�û���ټ�ˮ����
��ȡŨH2SO4ʱ������ŨH2SO4�����Ͳ�л���������Һ��δ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����CO2��NH3 ��ȣ�����˵������ȷ���ǣ� ��
A.���³�ѹ�£��ܶ�֮��Ϊ44��17B.������֮��Ϊ1��1
C.ԭ����֮��Ϊ1��1D.����֮��Ϊ44��17
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ������ʡ�����������˳�����е���
A.ͭ��ˮ�����´�B.���ס���ʯ�ҡ���ʯ��
C.Һ�����ռơ��D.�ɱ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ�������
A. ����������Һ��ϡ���ᷴӦ��Ba2++SO42��+H++OH��=BaSO4��+H2O
B. ��̼��þ�еμ�ϡ���CO32��+2H+=CO2��+H2O
C. ������ʯ��ˮ��ͨ�����������̼��Ca2++2OH��+CO2=CaCO3��+H2O
D. ��С�մ�����θ����ࣺHCO3��+H+=CO2��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com