
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
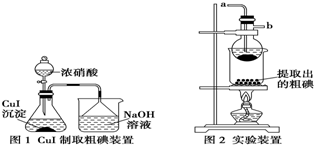
分析 (1)利用碘的升华性质提纯碘;
(2)A.标况下三氧化硫不是气体;
B.混合后溶液体积不是200mL;
C.根据稀释定律计算判断;
D.氢氧化钠为0.4mol,硫酸为0.6mol,反应后为硫酸钠、硫酸的混合溶液;
(3)铁离子水解溶液呈酸性,加入酸增大氢离子浓度,抑制其水解;
(4)由离子方程式可得关系式:6I-~6Fe2+~Cr2O72-,根据关系式计算;
(5)锥形瓶中CuI与浓硝酸反应生成I2、硝酸铜、二氧化氮与水;
(6)图2装置利用升华进行粗碘提纯,通入的冷凝水处于圆底烧瓶底部充分冷凝.
解答 解:(1)图2装置利用碘的升华性质提纯碘,装置中烧瓶的作用:升华分离冷凝回收碘,
故答案为:升华分离冷凝回收碘;
(2)A.标况下三氧化硫不是气体,22.4L三氧化硫表示1mol,且溶液体积也不是200mL,故A错误;
B.混合后溶液体积不是200mL,故B错误;
C.取5mol•L-1的H2SO4 80.0mL,加水至200mL,根据稀释定律,稀释后硫酸的浓度为$\frac{0.08L×5mol/L}{0.2L}$=2mol/L,故C正确;
D.氢氧化钠物质的量为$\frac{16g}{40g/mol}$=0.4mol,硫酸为0.2L×3mol/L=0.6mol,反应后为硫酸钠、硫酸的混合溶液,故D错误.
故选:C;
(3)铁离子水解溶液呈酸性,加热蒸发碘时会促进Fe3+水解,加入酸增大氢离子浓度,抑制其水解,
故答案为:加热蒸发碘时可有效抑制Fe3+水解,使后续测定结果更准确;
(4)消耗标准液的体积为$\frac{(19.60+19.65+19.55)mL}{3}$=19.60mL,设废液中I-的物质的量浓度为x mol/L,则:
6I-~6Fe2+~Cr2O72-
6 1
0.025L×x mol/L 0.0196L×0.025mol/L
所以 6:1=0.025L×x mol/L:0.0196L×0.025mol/L
解得x=0.1176
则该废液中I-的含量为0.1176mol/L×127g/mol=14.94g•L-1
故答案为:14.94;
(5)锥形瓶中CuI与浓硝酸反应生成I2、硝酸铜、二氧化氮与水,反应方程式为:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O,
故答案为:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O;
(6)图2装置利用升华进行粗碘提纯,通入的冷凝水处于圆底烧瓶底部充分冷凝,则a接水龙头,
故答案为:升华;a.
点评 本题考查物质含量测定、氧化还原反应滴定、物质的分离提纯、一定物质的量浓度溶液配制等,题目比较综合,注意多步反应计算中常利用关系解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
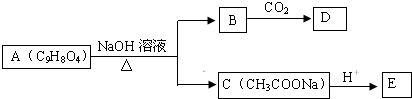
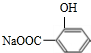 .
.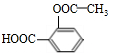 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$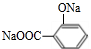 +CH3COONa+2H2O.
+CH3COONa+2H2O.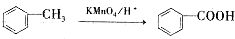 ,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)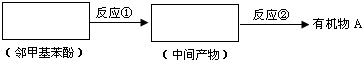
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-△H2 | B. | △H1-$\frac{1}{2}$△H2 | C. | 2△H1-△H2 | D. | $\frac{1}{2}$△H2-△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )| A. | 电解过程中阳极区发生如下反应:S2--2e-=S,(n-l)S+S2-=Sn2- | |
| B. | 电解时阴极的电极反应式:2H20+2e-═H2↑+20H- | |
| C. | 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成Sn2-+2H+═nS↓+H2↑ | |
| D. | 该装置的离子交换膜为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
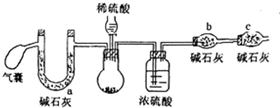 过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
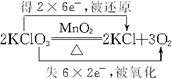 .
.
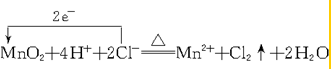 .
.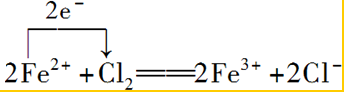 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6、C2H4O | B. | C2H4O、C2H4O2 | C. | C2H6O、C3H6O3 | D. | C3H8O3、C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积减半,则N2O4的浓度为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 平衡向右移动,但混合气体密度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com