
科目:高中化学 来源: 题型:

 (1)某实验小组用右图装置制取乙酸乙酯,请回答下列问题:
(1)某实验小组用右图装置制取乙酸乙酯,请回答下列问题:
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
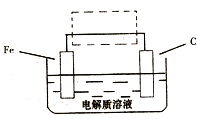 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


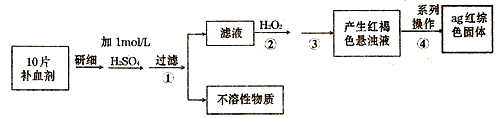
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||

| 18m(CuO) |
| m(H2O) |
| 18m(CuO) |
| m(H2O) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com