
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
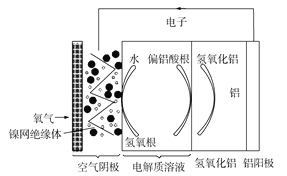
下列说法错误的是( )
A.若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+4OH=4![]() +2H2O
+2H2O
B.若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C.如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D.若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
科目:高中化学 来源: 题型:
【题目】硅烷是一种无色、与空气反应并会引起窒息的气体.其分子结构和![]() 相似,但
相似,但![]() 键键能比
键键能比![]() 键键能低。下列判断错误的是
键键能低。下列判断错误的是
A.![]() 分子呈正四面体形
分子呈正四面体形
B.![]() 分子是非极性分子
分子是非极性分子
C.因为![]() 键键能比
键键能比![]() 键键能低,所以
键键能低,所以![]() 沸点低于
沸点低于![]() 沸点
沸点
D.![]() 分子稳定性低于
分子稳定性低于![]() 分子,因为
分子,因为![]() 键键能高
键键能高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是 ( )

A.电负性:![]()
B.离子半径:![]()
C.![]() 分子中各原子的最外层均满足8电子稳定结构
分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子的最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 。请根据下表所列数据判断下列说法,其中错误的是
。请根据下表所列数据判断下列说法,其中错误的是![]()
![]()
元素 |
|
|
|
|
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是![]()
B.元素Y是第ⅢA族元素
C.同周期主族元素中,X的第一电离能最小
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的分子式为![]() ,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为
,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为![]() 和
和![]() ,下列推断不正确的是
,下列推断不正确的是
A.![]() 分子的空间构型为“V”形
分子的空间构型为“V”形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 与
与![]() 相比,
相比,![]() 的熔点、沸点比
的熔点、沸点比![]() 的低
的低
D.![]() 分子的中心原子的成键轨道为
分子的中心原子的成键轨道为![]() 杂化轨道
杂化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
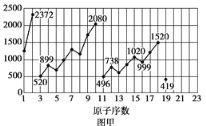
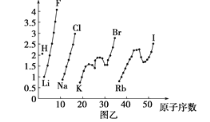
A. 图乙不可能表示元素的电负性随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l) ![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)已知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是____________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
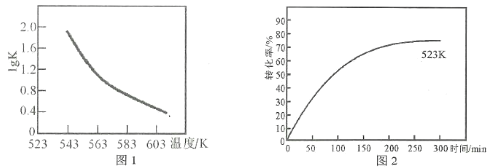
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列仪器可用于测定苯乙腈相对分子质量的是_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.红外光谱仪 D.质谱仪
(5)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
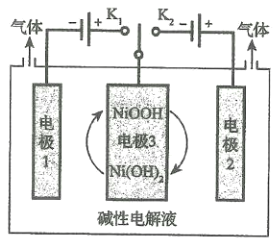
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、I-、NO3-、SO42-、
②pH=12的溶液中:![]() 、Na+、NO3-、S2-、
、Na+、NO3-、S2-、![]()
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出H2的溶液中:Mg2+、![]() 、Cl-、K+、
、Cl-、K+、![]()
⑤使石蕊变红的溶液中:Fe2+、![]() 、Na+、
、Na+、![]()
⑥中性溶液中:Fe3+、Al3+、![]() 、Cl-、
、Cl-、
A.②④B.只有②C.①②⑤D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,反应的化学方程式为ZnO+C![]() Zn+CO↑,此法为 .
Zn+CO↑,此法为 .
A.电解法 B.热还原法 C.热分解法.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com