
【题目】图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
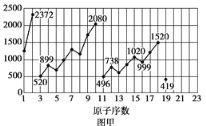
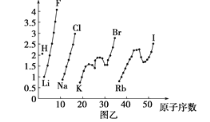
A. 图乙不可能表示元素的电负性随原子序数的变化关系
B. 图甲可能表示的是元素单质的熔点随原子序数的变化关系
C. 图乙可能表示的是元素原子的半径随原子序数的变化关系
D. 图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】将 16 克 CO 和 CO2 的混合气体通过足量的灼热的氧化铜后,得到气体的总质量为 22 克,求原混合气 体中 CO 的质量分数?_____若将所得的气体再通入到 100 克质量分数为 22.2%的澄清石灰水中,求所得沉淀的质量为多少克?________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4ClO4可用作火箭燃料,130℃时会分解产生三种单质气体和水。实验室中通过NaClO4与NH4Cl反应来制取NH4ClO4,NH4ClO4与NaCl的溶解度如下图。下列说法正确的是( )

A. NH4ClO4分解后产生的气体通入紫色石蕊溶液中,溶液变红色
B. NH4ClO4分解后产生的气体通过足量NaOH溶液,再通过足量灼烧的铜网,可得到纯净的单质气体
C. NH4ClO4与NaCl的混合溶液分离时,应采取蒸发浓缩,冷却结晶,过滤,得到NH4ClO4固体粗产品
D. 在NH4ClO4固体粗产品中加入NaOH浓溶液,加热,收集所得NH3体积,可计算粗产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X。

请回答:
(1)下列说法正确的是_________。
A.化合物B不能使溴水褪色
B.化合物C能与CuO发生氧化反应
C.化合物D的分子式是C9H10O2Br
D.化合物E到F发生的是加成反应
(2)化合物H的结构简式是________。
(3)已知I→X是取代反应,写出该反应的化学方程式________。
(4)化合物G的同分异构体有以下特征:①含有苯环;②1H﹣NMR谱显示分子中有3种氢原子;③分子结构中不存在氧氧键。请写出所有符合要求的结构简式(或键线式)___。
(5)已知:① ;②
;② ,请结合题目中已知信息设计由
,请结合题目中已知信息设计由![]() 合成
合成![]() 的路线________________________(用流程图表示)。
的路线________________________(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝 |
②中溶液产生胶状沉淀 | |
③中生成沉淀 | |
④中产生黄绿色气体 |
下列分析不正确的是
A. ①中溶液变蓝,体现了浓盐酸的氧化性
B. ②中产生白色胶状沉淀:2H++SiO32-=H2SiO3
C. ③中产生沉淀的原因可用平衡移动原理解释
D. ④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. 2KMnO4 +16HCl =2MnCl2 +5Cl2↑+8H2O
B. Fe + 2HCl = FeCl2 + H2↑
C. CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
D. 2KClO3 + H2C2O4 + H2SO4 ![]() 2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O
2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过最NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_____________________________________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是__________________________________________________________________。
II.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_________________________________________________。
(4)D装置的作用是____________________________________________。
(5)C中反应生成BaCO3的化学方程式是_________________________________________。
(6)下列各项措施中,不能提高测定准确度的是________(填标号)。
①在加入盐酸之前,应排净装置内的CO2气体
②滴加盐酸不宜过快
③在A-B之间增添盛有浓硫酸的洗气装置
④在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(7)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____________。
(8)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗疟药理活性的喹啉类衍生物,其合成路线流程图如下:

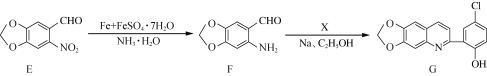
已知:
(1) F中的含氧官能团名称为________、________。
(2) B→C的反应类型为________。
(3)芳香族化合物X的分子式为C8H7ClO2,写出X的结构简式:___________________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________________________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com