
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率__(填“增大”“减小”或“不变”)。
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应速率的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,前10min正反应速率逐渐___(填“增大”“减小”或“不变”);前15 min内用SO3表示平均反应速率为__。
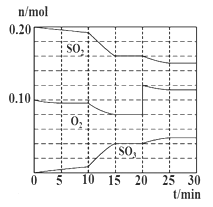
(3)图中反应进程,表示正反应速率与逆反应速率相等的时间段是___。
(4)根据上图判断,10min时改变的反应条件可能是___(填编号,下同);20min时改变的反应条件可能是___。
A.加入催化剂 B.缩小容器容积
C.降低温度 D.增加O2的物质的量
【答案】减小 减小 1.33×10-3mol/(Lmin) 15~20min和25~30min AB D
【解析】
(1)结合温度对速率的影响分析。
(2)10~15min反应物浓度逐渐减小、生成物浓度逐渐增大,说明正反应速率逐渐减小、逆反应速率逐渐增大;根据n=![]() 计算前15min内用SO2表示的平均反应速率;
计算前15min内用SO2表示的平均反应速率;
(3)当反应达到化学平衡状态时,各组分的浓度不随时间的变化而变化;
(4)10min到15min的时间段,化学反应速率加快,二氧化硫和氧气的量减小,三氧化硫的量增加;反应进行至20min时,氧气的物质的量增加,二氧化硫的减少,三氧化硫的增加,据此分析。
(1)降低温度,化学反应速率减小;
(2)根据图示可知,10~15min反应物浓度逐渐减小、生成物浓度逐渐增大,说明正反应速率逐渐减小;15min时三氧化硫的物质的量为0.04mol,前15min内用SO3表示的平均反应速率为:v(SO3)=![]() =1.33×10-3mol/(Lmin);
=1.33×10-3mol/(Lmin);
(3)根据图示曲线变化可知,15~20min、25~30min时间段,各组分的浓度不随时间的变化而变化,说明反应达到化学平衡状态;
(4)根据图象所示信息,10min到15min的时间段,化学反应速率加快,可以是加了催化剂或者是增大压强,或缩小容器体积,故答案为AB;反应进行至20min时,氧气的物质的量增加,二氧化硫的减少,三氧化硫的增加,可以推断是增加了O2的量,故答案为D。


科目:高中化学 来源: 题型:
【题目】已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可提高 SO2 的转化率
B.其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变
C.平衡前,充入氩气,容器内压强增大,反应速率加快
D.平衡时,其他条件不变,分离出硫,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的反应方程式不正确的是( )
A. 向碳酸钠溶液中滴加酚酞溶液,溶液变红:CO32-+2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
B. 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2+ + S2-===CuS↓
C. 向AgCl沉淀中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-![]() Ag2S+2Cl-
Ag2S+2Cl-
D. 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中溶液变蓝:4H++4I-+O2=== 2I2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g) ΔH>0在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
A.其他条件不变,仅将容器的体积缩小一半,v正减小而v逆增大
B.其他条件不变,升高温度,v正、v逆均增大且H2O(g)转化率增大
C.保持容器体积不变,充入少量He使体系压强增大,v正、v逆均增大
D.其他条件不变,适当增加C(s)的质量,v正增大而v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
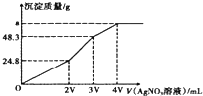
A.所加AgNO3溶液的物质的量浓度为![]() mol/L
mol/L
B.a的数值为62.65
C.常温下,AgCl,AgI,Ag2S在水中溶解能力依次减小
D.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________;
(2) ______________________;
______________________;
(3) __________________;
__________________;
(4) ________________________;
________________________;
(5) ____________________________;
____________________________;
(6)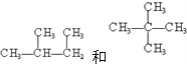 ________________________________;
________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
实验内容 | 实验目的 | |
A | 向某未知溶液中加入 | 检验是否含 |
B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含 |
C | 加热分别用 | 探究 |
D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com