
【题目】请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________;
(2) ______________________;
______________________;
(3) __________________;
__________________;
(4) ________________________;
________________________;
(5) ____________________________;
____________________________;
(6)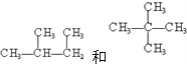 ________________________________;
________________________________;
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知研究氮及其化合物的转化对于环境改善有重大意义。
I.已知N2(g) +O2(g)=2NO(g) △H=+180.4 kJ/mol,
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=![]() kJ/mol。
kJ/mol。
(1)用NH3消除NO污染的反应为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
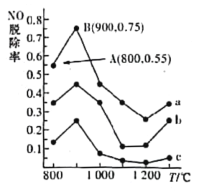
(2)不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。曲线a中NH3的起始浓度为4×10- 5mol/L,从A点到B点经过2秒,该时间段内NO的脱除速率为_______mg/(L·s),在AB所在的曲线上当温度高于900℃时NO脱除率明显降低的原因是_______________________________________________。
Ⅱ.用活性碳还原法也可以处理氮氧化合物,发生的反应为2CO(g)+ 2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ/mol。
N2(g)+2CO2(g) △H=-746.8kJ/mol。
(3)在一恒容绝热的密闭容器中,能表示上述反应达到平衡状态的是_____________(填字母代号)。
A.单位时间内断裂1 mol N≡N键的同时生成2 mol C=O键
B.容器内的总压强保持不变
C.混合气体的密度保持不变
D.c(NO):c(N2):c(CO2)=2:1:2
E.混合气体的平均摩尔质量保持不变
(4)向一恒容密闭容器中充入3mol CO和2mol NO,测得气体的总压为10MPa,在一定温度下开始反应,10 min后达到平衡,测得NO的转化率为75%,该反应的平衡常数KP=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。
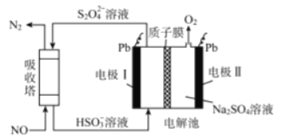
(5)写出吸收塔中的离子反应方程式_____________________________________,反应过程中若通过质子交换膜的H+为1 mol时,吸收塔中生成的气体在标准状况下的体积为_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量是衡量一个国家石油化工生产水平的重要标志,以A为主要原料合成一种具有果香味的物质E的生产流程如下:
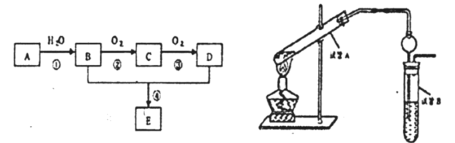
(1)有机物C的名称是_______________
(2)写出B→C的化学方程式________________
(3)请写出B+D→E的化学方程式________________
(4)试管A中加少许碎瓷片的目的是_______________
(5)试管B中试剂的作用是____________________
(6)右边试管接有一个球状物代替了长导管,其作用为______________
(7)从制备乙酸乙酯所得的混合物中分离提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是_____________(填字母)

(8)酯化反应是一一可逆反应, 为提高乙醇的利用率,可采取的措施是_______________。(任写一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热的恒容容器中,发生反应:X(s)+2Y(g)![]() M(g)+N(g),下列不能证明反应已达到平衡状态的是(注:绝热指不与外界发生热交换)
M(g)+N(g),下列不能证明反应已达到平衡状态的是(注:绝热指不与外界发生热交换)
A.某一时刻v(Y)=2v(M)B.混合气体的密度不变
C.容器内温度不变D.混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.H2SiO3![]() SiO2
SiO2 ![]() SiCl4
SiCl4
B.Cu![]() Cu(NO3)2(aq)
Cu(NO3)2(aq) ![]() Cu(NO3)2(s)
Cu(NO3)2(s)
C.ClCH2-CH2Cl![]() HOCH2-CH2OH
HOCH2-CH2OH ![]() HOOC-COOH
HOOC-COOH
D.Al![]() Al2O3
Al2O3![]() NaAlO2(aq)
NaAlO2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂可有效杀灭新冠病毒(2019-nCoV)。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。装置见下图。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3混合通入含水8%的碳酸钠中制Cl2O,并用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
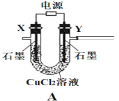
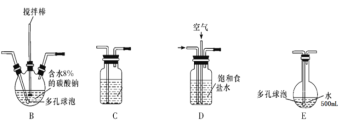

(1)电极Y应该连接电源的___(填“正极”或“负极”),装置C内应盛放_________,各装置的连接顺序为A—________________________________
(2)反应过程中,装置B需放在冷水中,其目的是_____________________________。已知装置B产物含有一种酸式盐,则发生反应的化学方程式为___________________。
(3)实验中控制氯气与空气体积比的方法是_______________________________
(4)装置E中使用棕色平底烧瓶的原因是(用化学方程式表示)________________
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com