
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
【答案】MN MN2 MN2 MN 离子键、非极性共价键 ![]()
【解析】
(1)对于A,阴离子位于立方体4个顶点,因此阴离子在该立方体内只有4×1/8=1/2 (个),同理阳离子也只有1/2个,组成上为1/2∶1/2=1∶1,表达式为MN;对于B,阴离子在立方体内有4×1/2+2=4(个),阳离子在立方体内有8×1/8+1=2(个),组成为MN2;对于C,阴离子在立方体内有1个,阳离子在立方体内有4×1/8=1/2(个),组成为MN2;对于D,阴离子在立方体内有1个,阳离子在立方体内有8×1/8=1(个),组成为MN。答案:MN、 MN2、 MN2、 MN 。
(2)FeS2晶体中的化学键为离子键和硫硫之间的非极性共价键。密度ρ=m/V,由立方体内阴、阳离子个数和摩尔质量可求出m,而由立方体的边长即阴、阳离子间的距离可求出立方体体积。ρ=(1/2![]() g
g![]() mol-1)=NAmol-1
mol-1)=NAmol-1![]() a3cm3g·cm-3=
a3cm3g·cm-3=![]() 。答案:离子键、非极性共价键 、
。答案:离子键、非极性共价键 、 ![]()


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是

A. 对应简单离子半径X<W
B. 对应气态氢化物的稳定性Y<Z
C. 化合物XZW既含离子键也含共价键
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g) ![]() Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
Cl2(g) + CO(g) △H>0达到平衡时各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出)。
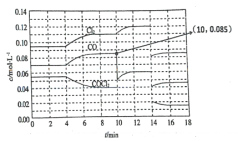
下列说法正确的是
A. 第4 min时改变的条件可能是扩大容器体积
B. 第2 min时的平衡常数K(2)大于第8 min时的平衡常数K(8)
C. 12 min时反应在温度T(8)下重新达到平衡,则此时c(COCl2) = 0.031 mol/L(结果保留两位有效数字)
D. 产物CO在2~3 min、5~6 min、12~13 min时的平均反应速率大小为:υ(5~6) > υ(2~3) > υ(12~13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是______________。
②已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是________________(选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率_______(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:____________________________。

(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接_______________。
产生H2的电极反应式是_______________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
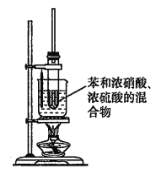
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com