
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:

①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。

已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。
【答案】-11 436 0.015p ![]() 或
或![]() 降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动 30 pH越低,吸光度越高或pH越高,吸光度越低 c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降
降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动 30 pH越低,吸光度越高或pH越高,吸光度越低 c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降
【解析】
(1)①用盖斯定律计算Q;
②利用ΔH=反应物总键能![]() 生成物总键能,求H—H键能;
生成物总键能,求H—H键能;
(2)①通过表中数据、按要求计算反应在前20min内的I2(g)平均速率![]() (I2);
(I2);
②在H2(g)+I2(g)![]() 2HI(g)中,温度为716K时,正反应速率v正=k正·c(H2)·c(I2)等于逆反应速率=v逆=k逆·c2(HI),处于平衡状态,据此可计算;
2HI(g)中,温度为716K时,正反应速率v正=k正·c(H2)·c(I2)等于逆反应速率=v逆=k逆·c2(HI),处于平衡状态,据此可计算;
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动的原因从体系内存在的其它变化来分析(此反应中逆反应为吸热方向);
2HI(g)达平衡后,降低温度,平衡可能逆向移动的原因从体系内存在的其它变化来分析(此反应中逆反应为吸热方向);
(3)①pH=4.8时,据图判断c(I2)最大的时间;
②10min时,不同pH与吸光度的关系可通过该图数据分析得出;
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能从物质的性质来分析;
(1)①设反应①H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1,反应②H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1,变化③I2(g)=I2(s) ΔH=-37.48kJ·mol-1,则反应①=反应②+变化③,故Q=-37.48+26.48=-11;
答案为:-11;
②按以上计算,则H2(g)+I2(g)=2HI(g) ΔH=-11kJ·mol-1,利用ΔH=反应物总键能![]() 生成物总键能=x+151-2×299=-11,x=436;
生成物总键能=x+151-2×299=-11,x=436;
答案为:436;
(2)①按题意知: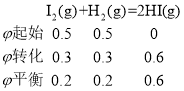 、则反应在前20min内的I2(g)平均速率
、则反应在前20min内的I2(g)平均速率![]() (I2)=
(I2)=![]() = 0.015p kPa·min-1;
= 0.015p kPa·min-1;
答案为:0.015p;
②在H2(g)+I2(g)![]() 2HI(g)中,温度为716K体系处于平衡状态时,v正=k正·c(H2)·c(I2) =v逆=k逆·c2(HI),则
2HI(g)中,温度为716K体系处于平衡状态时,v正=k正·c(H2)·c(I2) =v逆=k逆·c2(HI),则![]() ,图示平衡时
,图示平衡时 ![]() ,则
,则![]() ,则
,则![]()
![]() 或
或![]() ;
;
答案为:![]() 或
或![]() ;
;
③H2(g)+I2(g)![]() 2HI(g)为放热反应,若达平衡后物质状态及反应没有变化,则降低温度,平衡应该右移,现在逆向移动,则可能的原因从体系内存在的其它变化来分析,可能原因为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
2HI(g)为放热反应,若达平衡后物质状态及反应没有变化,则降低温度,平衡应该右移,现在逆向移动,则可能的原因从体系内存在的其它变化来分析,可能原因为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
答案为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
(3)①吸光度越高表明该体系中c(I2)越大,可由图知pH=4.8时,c(I2)最大的时间为30min;
答案为:30;
②吸光度越高表明该体系中c(I2)越大,10min时,![]() ,10 min时pH越低c(H+)越大,反应速率加快,c(I2)越高,吸光度越大;
,10 min时pH越低c(H+)越大,反应速率加快,c(I2)越高,吸光度越大;
答案为:pH越低,吸光度越高或pH越高,吸光度越低;
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降即c(I2)快速下降,也就是进一步反应了,这是因为c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化;
答案为:c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降。


科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类
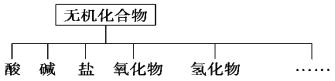
(1)图中所示的物质分类方法的名称是________。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式:___________。
(4)实验室制备⑦常用______和______反应,检验该气体的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) 2Z(g)+2W(g)在2 L密闭容器中进行,5 min时Y减少了0.5 mol,0~5 min内此反应的平均速率为
A.v(X)=0.05 mol·L1·min1
B.v(Y)=0.10 mol·L1·min1
C.v(Z)=0.10 mol·L1·min1
D.v(W)=0.05 mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与H2O反应中,Na2O2作氧化剂,H2O作还原剂
B.Na2O2与CO2反应中,Na2O2作还原剂,CO2作氧化剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。

(1)滤渣1的主要成分是__(写化学式),写出“硫化除铜”过程中发生的氧化还原反应的离子方程式___。
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是___。
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中 =__。(保留三位有效数字)
=__。(保留三位有效数字)
(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是___(填字母序号)。
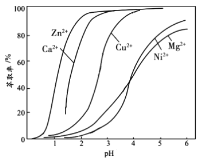
A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为__%。(保留三位有效数字,且不考虑杂质反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
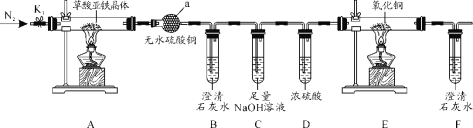
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COV1D-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗。其合成路线如下所示:

巳知:醛基在一定条件下可以还原成甲基。
回答下列问题:
(1)A中含氧官能团的名称为_____。
(2)下列说法中正确的是_____(填序号)。
a.可用新制氢氧化铜浊液鉴别开有机物A和D
b.物质D和E是同分异构体
c.可用红外光谱仪测定物质C的相对分子质量
d.由C生成D发生的是水解反应
(3)反应⑩的反应类型为_____,反应⑤若温度过高会发生副反应,请写出一个可能发生的副反应的化学方程式_____。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。磷酸氯喹(L)分子中有_____个手性碳。
(5)有机物E有多种同分异构体,其中属于酯的有_____种,在属于羧酸的同分异构体中,有一种核磁共振氢谱有两组峰,其结构简式为_____。
(6)以2一丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_____(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N 分别是由这四种元素组成的二元化合物,甲、乙为B、C两种元素对应的单质且摩尔质量相同。若X与Y的摩尔质量也相同,Y 与乙均为淡黄色固体上述物质之间的转化关系如图所示(部分反应物或生成物已省略),则下列叙述中正确的是
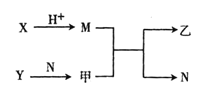
A.原子序数:A<B<C<D
B.简单离子半径关系:A < D <B<C
C.X、Y 中都只存在离子健
D.相对分子质量:M>N,沸点M >N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com