
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COV1D-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗。其合成路线如下所示:

巳知:醛基在一定条件下可以还原成甲基。
回答下列问题:
(1)A中含氧官能团的名称为_____。
(2)下列说法中正确的是_____(填序号)。
a.可用新制氢氧化铜浊液鉴别开有机物A和D
b.物质D和E是同分异构体
c.可用红外光谱仪测定物质C的相对分子质量
d.由C生成D发生的是水解反应
(3)反应⑩的反应类型为_____,反应⑤若温度过高会发生副反应,请写出一个可能发生的副反应的化学方程式_____。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。磷酸氯喹(L)分子中有_____个手性碳。
(5)有机物E有多种同分异构体,其中属于酯的有_____种,在属于羧酸的同分异构体中,有一种核磁共振氢谱有两组峰,其结构简式为_____。
(6)以2一丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_____(用箭头表示转化关系,箭头上注明试剂)。
【答案】醛基、醚键 ab 取代反应 CH3CO(CH2)3OH![]() CH3COCH2CH=CH2+H2O 1 9
CH3COCH2CH=CH2+H2O 1 9  CH3CH(OH)CH3
CH3CH(OH)CH3![]() CH3COCH3
CH3COCH3![]()

![]()
![]()
![]() CH3CH(NH2)CH3
CH3CH(NH2)CH3
【解析】
根据合成线路可知,A(![]() )与H2发生加成反应生成B(
)与H2发生加成反应生成B(![]() ),根据已知“醛基在一定条件下可以还原成甲基”可得B与H2在一定条件下发生还原反应生成C(
),根据已知“醛基在一定条件下可以还原成甲基”可得B与H2在一定条件下发生还原反应生成C(![]() ),C发生加成反应得到D,D的同分异构体E在浓硫酸、加热的条件下反应生成F[CH3CO(CH2)3Br],F再和NH(C2H5)2反应得到G,G发生加成反应生成H,H发生消去反应得到I,I与H2发生加成反应得到J,J发生取代反应生成K,K与磷酸制的L磷酸氯喹,据此分析解答问题。
),C发生加成反应得到D,D的同分异构体E在浓硫酸、加热的条件下反应生成F[CH3CO(CH2)3Br],F再和NH(C2H5)2反应得到G,G发生加成反应生成H,H发生消去反应得到I,I与H2发生加成反应得到J,J发生取代反应生成K,K与磷酸制的L磷酸氯喹,据此分析解答问题。
(1)根据题干信息,A的结构简式为![]() ,分子中的含氧官能团为醛基和醚键,故答案为:醛基、醚键;
,分子中的含氧官能团为醛基和醚键,故答案为:醛基、醚键;
(2)a.A的结构简式为![]() ,分子中含有醛基,能够与新制氢氧化铜浊液反应生成砖红色沉淀,而D不可以,因此可用新制氢氧化铜浊液鉴别开有机物A和D,a正确;
,分子中含有醛基,能够与新制氢氧化铜浊液反应生成砖红色沉淀,而D不可以,因此可用新制氢氧化铜浊液鉴别开有机物A和D,a正确;
b.由D和E的结构简式可知,D与E的分子式均为C5H10O2,结构不同,两者互为同分异构体,b正确;
c.用质谱仪测定物质C的相对分子质量,c错误;
d.根据上述分析可知,C发生加成反应得到D,d错误;
故答案为:ab;
(3)反应⑩为J发生取代反应生成K,反应⑤为E在浓硫酸、加热的条件下反应生成F[CH3CO(CH2)3Br],若温度过高会发生消去反应生成CH3COCH2CH=CH2,反应方程式为CH3CO(CH2)3OH![]() CH3COCH2CH=CH2+H2O,故答案为:取代反应;CH3CO(CH2)3OH
CH3COCH2CH=CH2+H2O,故答案为:取代反应;CH3CO(CH2)3OH![]() CH3COCH2CH=CH2+H2O;
CH3COCH2CH=CH2+H2O;
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳,根据磷酸氯喹(L)的结构可知,分子中 有1个手性碳原子,故答案为:1;/span>
有1个手性碳原子,故答案为:1;/span>
(5)有机物E的同分异构体中,属于酯的有![]() 、
、 、
、 、
、 、
、![]() 、
、 、
、![]() 、
、![]() 、
、 共9种,属于羧酸的同分异构体为CH3CH2CH2CH2COOH、
共9种,属于羧酸的同分异构体为CH3CH2CH2CH2COOH、![]() 、
、![]() 、
、 共4种,其中核磁共振氢谱有两组峰的结构简式为
共4种,其中核磁共振氢谱有两组峰的结构简式为 ,故答案为:9;
,故答案为:9; ;
;
(6)结合题干合成信息,可将2—丙醇催化氧化制得CH3COCH3,再在与NH3、无水乙醇得到 ,加入无水乙醇发生消去反应生成
,加入无水乙醇发生消去反应生成![]() ,最后与H2发生加成反应得到2-丙胺[CH3CH(NH2)CH3],合成路线为CH3CH(OH)CH3
,最后与H2发生加成反应得到2-丙胺[CH3CH(NH2)CH3],合成路线为CH3CH(OH)CH3![]() CH3COCH3
CH3COCH3![]()

![]()
![]()
![]() CH3CH(NH2)CH3,故答案为:CH3CH(OH)CH3
CH3CH(NH2)CH3,故答案为:CH3CH(OH)CH3![]() CH3COCH3
CH3COCH3![]()

![]()
![]()
![]() CH3CH(NH2)CH3。
CH3CH(NH2)CH3。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应:aA(g)+bB(g)![]() cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:

①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。

已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是

A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁在工农业生产中有重要的作用。工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3、SiO2等)为原料制备硫酸镁的流程如图:

(1)“酸溶”时MgCO3发生反应的离子方程式为___。
(2)滤渣的成分是___(填化学式)。
(3)加入H2O2氧化时,发生反应的离子方程式为___。
(4)将硫酸镁与木炭在800℃时煅烧,可以得到高纯度的MgO,煅烧过程中存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步收集、吸收或处理。

①装置A中U型管放在冷水中的目的是___,收集的物质是___。
②装置B、C中所盛放的试剂分别是___、___(填化学式)。
③装置D的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.检验溶液是否含有SO![]() 时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe3+时,用硝酸酸化
D.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员发现,在钙钛矿活性层中引入稀土Eu3+/Eu2+离子对,通过循环反应可消除零价铅和零价碘缺陷,大幅提高钙钛矿电池的使用寿命,其原理如图。下列说法正确的是
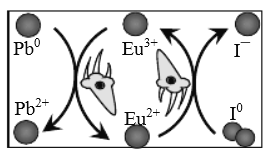
A.Eu3+/Eu2+离子对在反应过程中不断损耗,需定时补充
B.消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应
C.消除零价铅的反应为:2Eu3++Pb0=2Eu2++Pb2+
D.整个过程实质上将电子从I0转移给Pb0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com