
【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。

【答案】3d1 3TiO2++Al+6H+=3Ti3++Al3++3H2O Ti3+ TiC为原子晶体,TiCl4为分子晶体,共价键的键能高于分子间作用力 N、O N [Ca(EDTA)] 2-+ Pb2+=[Pb(EDTA)] 2-+ Ca2+ La 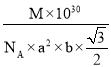 (
(![]() ,
,![]() ,0)
,0)
【解析】
根据原子核外电子排布书写离子价电子排布式,根据晶体类型分析物质熔沸点差异原因,结合原子半径和全满、半满规律判断电离能大小,根据均摊法及立体几何知识进行相关计算。
(1)Ti的核外电子排布式为[Ar]3d24s2,Ti失去3个电子变成Ti3+,则Ti3+的价电子排布式为3d1,由题干信息,某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,Al转化为Al3+,则离子反应方程式为3TiO2++Al+6H+=3Ti3++Al3++3H2O,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定,说明Fe3+先于Ti3+反应,加入的最后一滴FeCl3标准溶液与SCN-反应生成红色络合物,故答案为:3d1;3TiO2++Al+6H+=3Ti3++Al3++3H2O;Ti3+;
(2)根据表格数据分析可知,TiC为原子晶体,TiCl4为分子晶体,由于共价键的键能远远高于分子间作用力,因此TiC的熔沸点明显高于TiCl4,故答案为:TiC为原子晶体,TiCl4为分子晶体,共价键的键能高于分子间作用力;
(3)根据EDTA的结构分析壳子,分子中N原子和O原则含有孤对电子,可作配位原子,由于N原子的2p轨道处于2p3的半充满结构,更不易失去电子,第一电离能更大,EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,因此用Na2[Ca(EDTA)]治疗铅中毒时,发生反应[Ca(EDTA)]2-+Pb2+=[Pb(EDTA)]2-+Ca2+,故答案为:N、O;N;[Ca(EDTA)]2-+Pb2+=[Pb(EDTA)]2-+Ca2+;
(4)图乙的晶胞为六方晶胞,其8个顶点的原子平均有八分之一(其中4个占六分之一、另外4个占十二分之一)属于该晶胞,面上的原子有二分之一属于该晶胞,故其中含有![]() 的数目为
的数目为![]() ,含有
,含有![]() 的数目为
的数目为![]() ,两者个数之比为5:1,则
,两者个数之比为5:1,则![]() 代表La原子,图乙晶胞中,一个晶胞中含有1个LaNi5,则晶胞的质量为
代表La原子,图乙晶胞中,一个晶胞中含有1个LaNi5,则晶胞的质量为![]() ,一个晶胞的体积为
,一个晶胞的体积为![]() ,则晶胞的密度
,则晶胞的密度 ,图乙晶胞中原子坐标参数A为(0,0,0),B为(
,图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为(
),则C点的原子坐标参数为(![]() ,
,![]() ,0),故答案为:La;
,0),故答案为:La;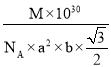 ;(
;(![]() ,
,![]() ,0)。
,0)。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与H2O反应中,Na2O2作氧化剂,H2O作还原剂
B.Na2O2与CO2反应中,Na2O2作还原剂,CO2作氧化剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COV1D-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗。其合成路线如下所示:

巳知:醛基在一定条件下可以还原成甲基。
回答下列问题:
(1)A中含氧官能团的名称为_____。
(2)下列说法中正确的是_____(填序号)。
a.可用新制氢氧化铜浊液鉴别开有机物A和D
b.物质D和E是同分异构体
c.可用红外光谱仪测定物质C的相对分子质量
d.由C生成D发生的是水解反应
(3)反应⑩的反应类型为_____,反应⑤若温度过高会发生副反应,请写出一个可能发生的副反应的化学方程式_____。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。磷酸氯喹(L)分子中有_____个手性碳。
(5)有机物E有多种同分异构体,其中属于酯的有_____种,在属于羧酸的同分异构体中,有一种核磁共振氢谱有两组峰,其结构简式为_____。
(6)以2一丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_____(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下,则下列说法不正确的是
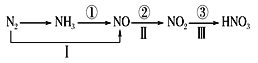
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
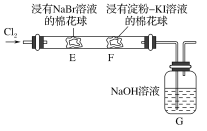
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N 分别是由这四种元素组成的二元化合物,甲、乙为B、C两种元素对应的单质且摩尔质量相同。若X与Y的摩尔质量也相同,Y 与乙均为淡黄色固体上述物质之间的转化关系如图所示(部分反应物或生成物已省略),则下列叙述中正确的是
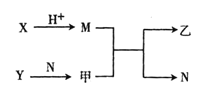
A.原子序数:A<B<C<D
B.简单离子半径关系:A < D <B<C
C.X、Y 中都只存在离子健
D.相对分子质量:M>N,沸点M >N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是一种危险化学制品,具有腐蚀性、可自燃性。主要用于医药工业,在有机合成中用作催化剂等。其结构如图所示,其中W、X、Y、Z是处于三个不同短周期且原子序数依次递增的常见元素,X、Y核外电子层数相同,Y核外最外层电子数是X内层电子数的3倍。下列叙述正确的是( )
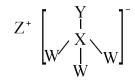
A.原子半径:Y>X>Z>W
B.简单气态氢化物的稳定性:X>Y
C.X与W形成的常见化合物有两种
D.W和Z形成的化合物为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com