
【题目】关于氮的变化关系图如下,则下列说法不正确的是
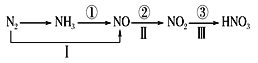
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气在足量的氧气中通过一步反应可生成NO2
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计蔗糖与浓硫酸反应的实验装置如下,并进行系列实验(必要时可对甲适当加热)。下列说法中正确的是

A.可观察到棉球a、b都褪色,且褪色的原理相同
B.丙、丁中都能观察到有白色沉淀生成
C.实验过程中观察到的系列现象,可验证浓硫酸具有吸水性、脱水性和氧化性
D.m管的作用是平衡压强,戊的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.检验溶液是否含有SO![]() 时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe3+时,用硝酸酸化
D.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员发现,在钙钛矿活性层中引入稀土Eu3+/Eu2+离子对,通过循环反应可消除零价铅和零价碘缺陷,大幅提高钙钛矿电池的使用寿命,其原理如图。下列说法正确的是
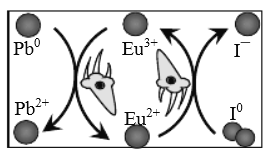
A.Eu3+/Eu2+离子对在反应过程中不断损耗,需定时补充
B.消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应
C.消除零价铅的反应为:2Eu3++Pb0=2Eu2++Pb2+
D.整个过程实质上将电子从I0转移给Pb0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是

A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02evmol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子结构示意图分别为
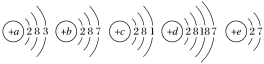
请回答下列问题:
(1)属于同周期的元素是________(填元素符号,下同),属于同主族的元素是________。
(2)金属性最强的元素是________,非金属性最强的元素是________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)2 mol CO(NH2)2中含_____molN原子, 所含O原子数跟________g H2O所含氧原子数相等。
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,含R的质量为1.6 g的Na2R,其物质的量为_________。
(3)CO和CO2的混合气体18 g,在标准状况下的体积为11.2 L,则混合气体的平均摩尔质量为________,混合气体中CO的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com