
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。
(1)钠的原子结构示意图为___。
(2)写出该反应的化学方程式___;其中钠熔成闪亮小球的原因是___。
(3)将所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式___;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为___(填化学式),如称量其质量为4.0g,通过计算,可知最初加入的金属钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
A.检验溶液是否含有SO![]() 时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
时,先用盐酸将待检验溶液酸化,然后往其中滴加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe3+时,用硝酸酸化
D.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是

A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02evmol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
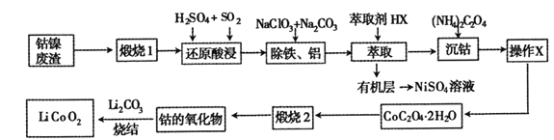
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
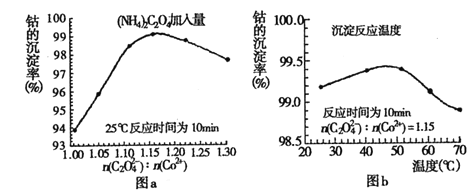
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
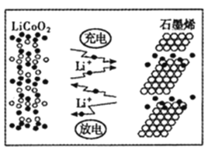
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子结构示意图分别为
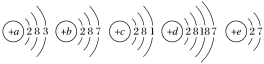
请回答下列问题:
(1)属于同周期的元素是________(填元素符号,下同),属于同主族的元素是________。
(2)金属性最强的元素是________,非金属性最强的元素是________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应.
反应①:4NH3 (g)+6NO(g) ![]() 5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
反应②:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) H2=?
5N2(g)+3O2(g)+6H2O(l) H2=?
反应③:2NO(g)+O2(g) ![]() 2NO2(g) H3=-113.0kJ·mol一1
2NO2(g) H3=-113.0kJ·mol一1
(1)反应②的H2==_____________。
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。
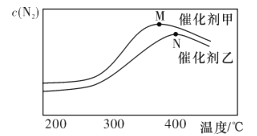
①反应①的平衡常数的表达式K=________。相同温度下.在催化剂甲的作用下反应的平衡常数______(填“大于”“小于”或“等于”)在催化剂乙的作用下反应的平衡常数。
②N点后N2浓度减小的原因可能是_____________________。
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为____,达平衡所用时间为5 min.则用NO表示此反应0~5 min内的平均反应速率为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或者结论正确的是( )
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,使用前还要检验是否漏水
B.实验室配制100.0 g,20%的氯化钠溶液,可取20.0 g的NaCl于烧杯中,再加入80.0 mL的水,充分搅拌后即可
C.实验室里需要480 mL 2.0 mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀等步骤进行操作
D.实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,如果在称量时把砝码和硫酸亚铁固体放反(其他操作都正确),则最终溶液浓度会偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com