
【题目】把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。
(1)钠的原子结构示意图为___。
(2)写出该反应的化学方程式___;其中钠熔成闪亮小球的原因是___。
(3)将所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式___;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为___(填化学式),如称量其质量为4.0g,通过计算,可知最初加入的金属钠的质量为___g。
【答案】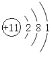 2Na+2H2O=2NaOH+H2↑ 钠和水反应放热,且钠的熔点低 2Al+2OH-+2H2O=2AlO2-+3H2↑ 3OH-+Fe3+=Fe(OH)3↓ Fe2O3 3.45
2Na+2H2O=2NaOH+H2↑ 钠和水反应放热,且钠的熔点低 2Al+2OH-+2H2O=2AlO2-+3H2↑ 3OH-+Fe3+=Fe(OH)3↓ Fe2O3 3.45
【解析】
(1)钠的原子结构示意图为: 。答案为:
。答案为:
(2)钠和水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑;钠的熔点低,而反应放热,温度升高,达到钠的熔点,使钠熔成闪亮小球。答案为:2Na+2H2O=2NaOH+H2↑;钠和水反应放热,且钠的熔点低
(3)将所得溶液平均分成两份:
①所得溶液为NaOH溶液,能与加入的铝片反应,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
②NaOH溶液与FeCl3溶液反应生成红褐色的Fe(OH)3沉淀,反应的离子方程式为:3OH-+Fe3+=Fe(OH)3↓ ;将沉淀过滤、洗涤、干燥、灼烧,Fe(OH)3分解得到Fe2O3,根据各反应可列出关系式计算:
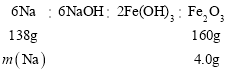
m(Na)=![]() =3.45g
=3.45g
即最初加入的金属钠的质量为3.45g。
答案为:3OH-+Fe3+=Fe(OH)3↓ ;Fe2O3;3.45


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
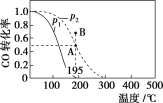
p2及195 ℃ 时n(H2)随时间变化
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
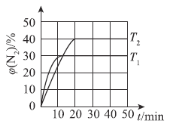
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2O2与CO2、H2O反应的叙述正确的是( )
A.Na2O2与H2O反应中,Na2O2作氧化剂,H2O作还原剂
B.Na2O2与CO2反应中,Na2O2作还原剂,CO2作氧化剂
C.Na2O2与CO2反应中,1molNa2O2转移2mol电子
D.Na2O2与水反应中,1molNa2O2转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是

A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1mol二氧化碳可收集到标准状况下 11.2L 氢气
C.若生成0.5 mol 草酸铝,有3mol电子通过电解质溶液
D.正极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
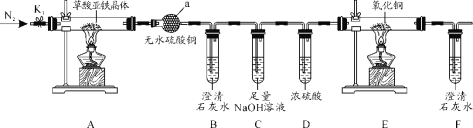
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化。
试剂:S、CO2、Na2CO3溶液、Na3PO4溶液、K2SO4溶液、浓硝酸、浓盐酸
①K2O(一种碱性氧化物)K2CO3的化学方程式:___;
②PH3PO4的化学方程式:___;
③浓硫酸SO2的化学方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。

①“反应Ⅱ”为复分解反应,写出该反应的化学方程式:___;
②“反应Ⅰ”的产物之一为NaCl,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com