
【题目】最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是

A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1mol二氧化碳可收集到标准状况下 11.2L 氢气
C.若生成0.5 mol 草酸铝,有3mol电子通过电解质溶液
D.正极的电极反应式为![]()
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一小块金属钠投入水中,观察到以下各种现象:钠浮在水面上,熔成闪亮的小球,四处游动,逐渐减少,直至消失。
(1)钠的原子结构示意图为___。
(2)写出该反应的化学方程式___;其中钠熔成闪亮小球的原因是___。
(3)将所得溶液平均分成两份:
①一份加入足量的铝片充分反应,写出该反应的离子方程式:___。
②向另一份溶液中滴加FeCl3溶液至沉淀不再增加,写出生成沉淀的反应的离子方程式___;继续将沉淀过滤、洗涤、干燥、灼烧,此时得到的固体为___(填化学式),如称量其质量为4.0g,通过计算,可知最初加入的金属钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
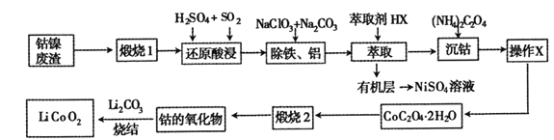
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
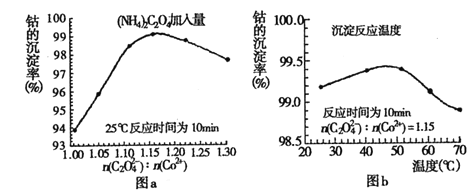
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
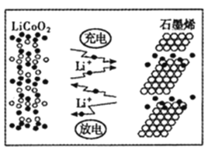
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com