
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】某同学应用如下所示装置研究物质的性质。其中气体X的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:
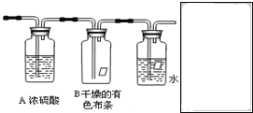
(1)B中观察到的实验现象是___。
(2)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在图方框内),用化学方程式表达原理___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
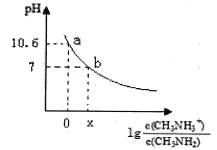
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
① 2-甲基丁烷和丁烷________________, ②正戊烷和2,2-二甲基丙烷____________,③对二甲苯和1,4—二甲苯____________ , ④ 1-已烯和环已烷________________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
① CH3CH2CH2COOH ② ![]() ③
③![]()
④ ![]() ⑤
⑤ ![]() ⑥
⑥ 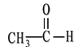
(1)芳香烃:__________;
(2)卤代烃:____________;
(3)酚:_______________;
(4)醛:______________;
(5)羧酸:______________;
(6)酯:_______________。
III.(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)![]() N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1D. 容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用石墨作电极进行如下实验,实验观察到:a、d处试纸变蓝;b处变红,并局部褪色;c处无明显变化。下列说法中错误的是
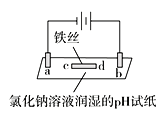
A. a极为阴极,发生的电极反应为2H++2e-=H2↑
B. b极为阳极,涉及的反应有2Cl--2e-=Cl2↑、Cl2+H2O![]() HCl+HClO
HCl+HClO
C. 电解过程中,a点电势低于c点电势,所以电子由a点移向c点
D. 若将铁丝改成铜丝,其余条件相同,电解一段时间后,能发现c处附近变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com