
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
【答案】B
【解析】
A.在反应FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O中,N元素的化合价由反应前KNO3中的+5价变为反应后NO中的+2价,化合价降低,获得电子,所以该反应的氧化剂是KNO3,A正确;
Fe2(SO4)3+NO↑+K2SO4+H2O中,N元素的化合价由反应前KNO3中的+5价变为反应后NO中的+2价,化合价降低,获得电子,所以该反应的氧化剂是KNO3,A正确;
B. 配平的化学方程式为6FeSO4+2KNO3+4H2SO4(浓)![]() 3Fe2(SO4)3+2NO↑+K2SO4+4H2O,在该反应中KNO3作氧化剂,还原产物是NO,FeSO4作还原剂,Fe2(SO4)3是氧化产物,根据反应过程中电子转移数目相等,所以n(KNO3):n(FeSO4)=1:3=2:6,则氧化产物Fe2(SO4)3与还原产物NO的物质的量之比为3∶2,B错误;
3Fe2(SO4)3+2NO↑+K2SO4+4H2O,在该反应中KNO3作氧化剂,还原产物是NO,FeSO4作还原剂,Fe2(SO4)3是氧化产物,根据反应过程中电子转移数目相等,所以n(KNO3):n(FeSO4)=1:3=2:6,则氧化产物Fe2(SO4)3与还原产物NO的物质的量之比为3∶2,B错误;
C.Fe2(SO4)3、K2SO4都是盐,属于强电解质,H2O能部分电离产生自由移动的离子,是弱电解质,因此这几种物质均为电解质,C正确;
D.根据方程式可知:每反应产生72g H2O,转移6mol电子, 则生成144g H2O,转移电子的物质的量为12mol,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】如图表示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是
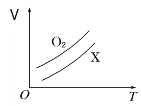
A. C2H4 B. CH4
C. CO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗丙肝新药的中间体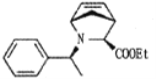 合成路线图如下:
合成路线图如下:
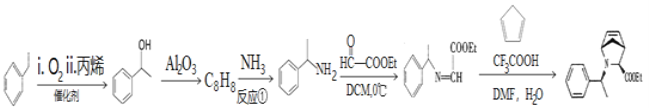
已知:-Et为乙基,DCM与DMF均为有机溶剂。
(1) ![]() 的名称是_____________,
的名称是_____________,![]() 所含官能团的名称是______________。
所含官能团的名称是______________。
(2) 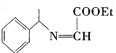 的分子式为_______________________。
的分子式为_______________________。
(3) 反应①化学方程式为_____________,(不用写反应条件)反应类型属于是___________。
(4)写出一种与 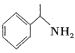 互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____________________________
互为同分异构体的芳香类化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:6,且不含-NH2)____________________________
(5) 设计由乙醇、1,3-丁二烯和甲氨( CH 3 NH 2 )合成 ![]() 路线(其他试剂任选,不需写每一步的化学方程式,应写必要的反应条件)。_________________________
路线(其他试剂任选,不需写每一步的化学方程式,应写必要的反应条件)。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类化合物在维生素C的作用下能够转化为有毒的+3价的含砷化合物。通过以上信息填空:上述过程中+5价砷类物质作为______(填氧化剂或还原剂),+5价砷元素发生______反应(填氧化或还原);0.5mol+5价砷完全转化为+3价砷,共转移______个电子。
(2)实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①用双线桥标出电子转移方向和数目______;(在答题纸上标)
②在标准状况下生成的氯气为11.2L时,被氧化的HCl的质量为______;
③为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,写出反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH。其中能导电的是___,(填序号,下同),属于电解质的是___,属于非电解质的是___。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q___2p(填“大于”、“小于”、或“等于”)。
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为____%(小数点后保留一位数字);若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
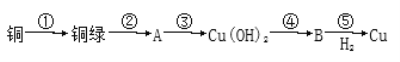
(1)从物质分类标准看,“铜绿”属于___(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:___。
(3)上述转化过程中属于氧化还原反应的是___(填序号)
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com