
【题目】(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH。其中能导电的是___,(填序号,下同),属于电解质的是___,属于非电解质的是___。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q___2p(填“大于”、“小于”、或“等于”)。
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为____%(小数点后保留一位数字);若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为____%。
【答案】③⑤⑥⑦ ②④⑦ ① 大于 33.3 40
【解析】
(1)电解质和非电解质均为化合物,酸、碱、盐、金属氧化物等均属于电解质,绝大部分有机物、非金属氧化物、非金属氢化物等为非电解质;据此可以推出属于电解质的是②NaHCO3晶体、④纯醋酸、⑦熔融KOH;属于非电解质的是①干冰;金属都能导电,存在自由移动的离子的物质都能导电,其中能导电的是③氨水、⑤FeCl3溶液、⑥铜⑦熔融KOH;正确选项:③⑤⑥⑦;②④⑦;①;
(2)令质量分数为p%的硫酸的密度为dg/mL,3p%的硫酸的密度为Dg/mL,溶液体积为VmL,则混合后溶液的质量为:dg/mL×VmL+Dg/mL×VmL=V(d+D)g,混合后溶质硫酸的总质量为dg/mL×VmL×p%+Dg/mL×VmL×3p%=V(d×p%+D×3p%)g,混合后硫酸的质量分数q%=![]() =p%+
=p%+![]() =p%+2p%×
=p%+2p%×![]() ,硫酸溶液的浓度越大,其密度越大,则d<D,故1+
,硫酸溶液的浓度越大,其密度越大,则d<D,故1+![]() <2,所以2p%×
<2,所以2p%×![]() >p%,q%>2p%,即q>2p,正确答案是大于;
>p%,q%>2p%,即q>2p,正确答案是大于;
(3)三种气体混合气体的平均相对分子质量为20×2=40,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设混合气体的总物质的量为1mol,其中SO2的物质的量为xmol,则CO和N2的物质的量之和为(1x)mol,因此有:64x+28(1x)=40×1,解得x=![]() 。SO2的体积分数为
。SO2的体积分数为![]() ×100%=33.3%;若CO和N2的物质的量之比为1∶1,设混合气体为1mol,则混合气体中SO2的物质的量为:
×100%=33.3%;若CO和N2的物质的量之比为1∶1,设混合气体为1mol,则混合气体中SO2的物质的量为:![]() mol,CO和N2的物质的量都是(1-
mol,CO和N2的物质的量都是(1-![]() )÷2=
)÷2=![]() mol,混合气体中氧元素的物质的量为
mol,混合气体中氧元素的物质的量为![]() ×2+
×2+![]() =1mol,氧元素的质量分数为
=1mol,氧元素的质量分数为![]() ×100%=40%。
×100%=40%。


科目:高中化学 来源: 题型:
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)![]() N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1D. 容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
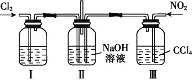
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
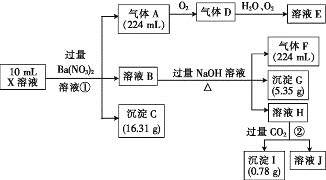
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用石墨作电极进行如下实验,实验观察到:a、d处试纸变蓝;b处变红,并局部褪色;c处无明显变化。下列说法中错误的是
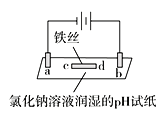
A. a极为阴极,发生的电极反应为2H++2e-=H2↑
B. b极为阳极,涉及的反应有2Cl--2e-=Cl2↑、Cl2+H2O![]() HCl+HClO
HCl+HClO
C. 电解过程中,a点电势低于c点电势,所以电子由a点移向c点
D. 若将铁丝改成铜丝,其余条件相同,电解一段时间后,能发现c处附近变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,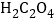 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com