
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
【答案】(1)CuO+H2SO4=CuSO4+H2O(2分)
(2)Al(OH)3(2分);CuO(2分)
(3)过滤(1分)(4)50(2分)25(2分)
(5)蒸发浓缩、冷却结晶(2分)
【解析】
试题分析:(1)滤渣中含有氧化铜,与稀硫酸反应的方程式为CuO + H2SO4 =CuSO4 + H2O;
(2)CuAlO2中氧为—2价,铝为+3价,则铜为+1价,因此其化学式也可以写为Cu2OAl2O3,相当于氧化亚铜和氧化铝按物质的量之比为1∶1熔合在一起,由此逆推,固体B的主要成分是物质的量之比为1∶1的Al(OH)3和CuO,即固体混合物A的组成为Al(OH)3、CuO;
(3)操作A是分离不溶性固体和液体的方法,属于过滤;
(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×64%=3200g,铜元素的相对原子质量为64,由m/M=n可求铜的物质的量为3200g÷64g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;
(5)胆矾的化学式为CuSO45H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】用饱和硫酸亚铁、浓硫酸和硝酸钾反应可以制得纯度为98%的NO,其反应为FeSO4+KNO3+H2SO4(浓)![]() Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
Fe2(SO4)3+NO↑+K2SO4+H2O(未配平)。下列有关说法不正确的是
A. 该反应的氧化剂是KNO3
B. 氧化产物与还原产物的物质的量之比为2∶3
C. Fe2(SO4)3、K2SO4、H2O均为电解质
D. 该反应中生成144gH2O,转移电子的物质的量为12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用石墨作电极进行如下实验,实验观察到:a、d处试纸变蓝;b处变红,并局部褪色;c处无明显变化。下列说法中错误的是
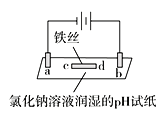
A. a极为阴极,发生的电极反应为2H++2e-=H2↑
B. b极为阳极,涉及的反应有2Cl--2e-=Cl2↑、Cl2+H2O![]() HCl+HClO
HCl+HClO
C. 电解过程中,a点电势低于c点电势,所以电子由a点移向c点
D. 若将铁丝改成铜丝,其余条件相同,电解一段时间后,能发现c处附近变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2、O3 是氧元素的同素异形体,性质都相似
B. 35Cl与37Cl-互为同位素
C. 乙二醇( ![]() ) 和甘油(
) 和甘油( ![]() )互为同系物
)互为同系物
D. CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,两个体积相同的玻璃密闭容器中分别盛满氮气和氧气,则容器中氮气和氧气的质量之比为___________________________。
(2)在标准状况下,11.2L某氮氧化物NOx气体的质量是23g,则x的值为___________________。
(3)200 mL Fe2(SO4)3溶液中含56g Fe3+,溶液中SO42—的物质的量浓度是___________________。
(4)一定质量的某金属元素R的硝酸盐受热完全分解,反应按下式进行:2R(NO3)2=2RO+4NO2↑+O2↑若得到1mol RO固体,则得到的气体在标准状况下的总体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A. 它难溶于水,但易溶于苯
B. 该物质含苯环的同分异构体(不包括它本身)共有5种
C. 它会使酸性高锰酸钾溶液褪色
D. 一定条件下以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,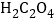 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
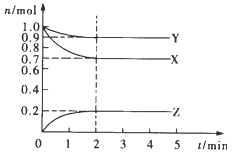
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
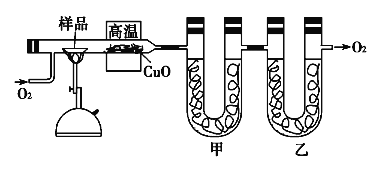
试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com