
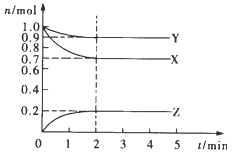
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
【答案】3X+Y![]() 2Z 0.05mol/(L·min) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol Cu(OH)2 Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+ S2-+H2O
2Z 0.05mol/(L·min) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol Cu(OH)2 Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+ S2-+H2O ![]() HS-+OH-
HS-+OH-
【解析】
(1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,参加反应的物质的物质的量之比等于化学计量数之比;根据υ=![]() ,计算v(Z);
,计算v(Z);
(2)根据燃烧热的概念,运用盖斯定律,就可以得到甲烷燃烧的热化学方程式;
(3) Mg(OH)2、Cu(OH)2的类型相同,根据溶度积常数越小,先形成沉淀判断;
(4)根据盐的组成,结合盐的水解规律分析判断。
(1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,参加反应的物质的物质的量之比等于化学计量数之比,所以该反应的化学方程式为3X+Y![]() 2Z;根据方程式可知在2min内Z的物质的量增加了0.2mol,由于容器的容积为2L,则υ(Z)=
2Z;根据方程式可知在2min内Z的物质的量增加了0.2mol,由于容器的容积为2L,则υ(Z)=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(2)甲烷的燃烧热是101kPa时,1mol甲烷完全燃烧产生CO2气体和液态水时放出的热量。根据盖斯定律,将[①+②]÷2,整理可得:甲烷燃烧热的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol;
(3)由于Ksp[Mg(OH)2]=1.8×10-11>Ksp[Cu(OH)2]=2.2×10-20,Mg(OH)2、Cu(OH)2的类型相同,所以Cu(OH)2先生成沉淀;一水合氨是一元弱碱,与Cu2+结合形成Cu(OH)2沉淀,生成该沉淀的离子方程式为Cu2+ +2NH3·H2O=Cu(OH)2 ↓+2NH4+;
(4)Na2S是强碱弱酸盐,在溶液中,S2-发生水解反应,消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),使溶液具有较强的碱性,水解反应的离子方程式为:S2-+H2O ![]() HS-+OH-。
HS-+OH-。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】我国很早就使用青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
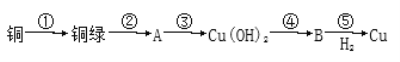
(1)从物质分类标准看,“铜绿”属于___(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)请写出铜绿与盐酸反应的离子方程式:___。
(3)上述转化过程中属于氧化还原反应的是___(填序号)
(4)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是______(填序号)。
2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是______(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d. 达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:
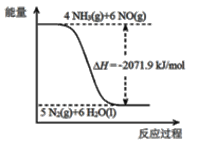
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
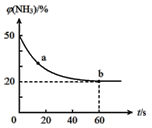
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为________________。
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为________________。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
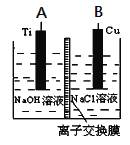
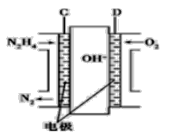
上述装置中阳极反应式为________________________,该电解池中的离子交换膜为________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a 和 b 不连接时,铁片上会有金属铜析出
B. 无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
C. a 和 b 分别连接直流电源正、负极,铜片上发生的反应为:Cu-2e-=Cu2+
D. a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
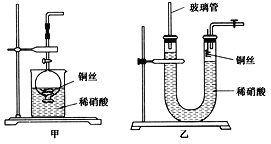
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
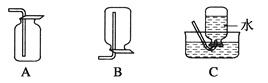
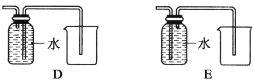
合理的是________(填选项代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置。

(1)A是氯气发生装置,其中发生反应的离子方程式为___。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为___。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是___。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是___。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是___。
(6)某同学用如图的装置来验证氯气的有关性质:

①该同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因___。
②该同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是___,由此得出Cl2使有色物质褪色的机理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2=2KCl+I2,碘与溴一样易溶于有机溶剂):
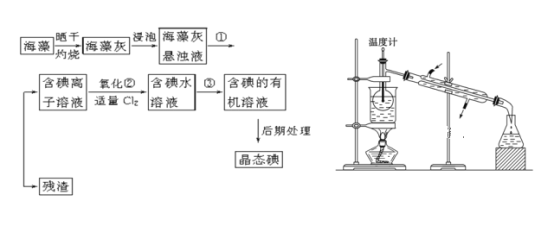
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A 苯 B 四氯化碳 C 酒精 D 醋酸
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是___________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①__________。②_____________。③_________。
(5)进行上述蒸馏操作时使用水浴的原因是__________。
(6)如果本实验用苯做萃取剂,则上层液体的颜色为_______色,下层液体中溶质的主要成分为___________(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com