
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置。

(1)A是氯气发生装置,其中发生反应的离子方程式为___。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为___。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是___。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是___。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是___。
(6)某同学用如图的装置来验证氯气的有关性质:

①该同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因___。
②该同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是___,由此得出Cl2使有色物质褪色的机理是___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2Cl2+2H2O+C
Mn2++Cl2↑+2H2O 2Cl2+2H2O+C![]() CO2+4HCl 吸收Cl2和HCl气体,防止污染环境 储存多余的Cl2 随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发 Cl2被碱石灰吸收 干燥有色布条不褪色,而湿润有色布条褪色 Cl2与水反应生成HClO,而HClO具有漂白性
CO2+4HCl 吸收Cl2和HCl气体,防止污染环境 储存多余的Cl2 随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发 Cl2被碱石灰吸收 干燥有色布条不褪色,而湿润有色布条褪色 Cl2与水反应生成HClO,而HClO具有漂白性
【解析】
(1)A是氯气发生装置,药品为MnO2、浓盐酸,二者发生氧化还原反应,生成Cl2。
(2)D装置的硬质玻璃管内盛有炭粉,与带有水蒸气的氯气发生氧化还原反应,其产物为CO2和HCl。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是尾气处理。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是将后来生成的氯气储存。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,从氯化氢的挥发、仪器中存留、稀盐酸与MnO2不反应等方面进行分析。
(6)①该同学实验后并没有得到预期的实验现象,主要从Cl2有无进入广口瓶内分析原因。
②该同学在实验中使用干燥布条、潮湿布条,他预期的实验现象应为布条是否褪色,由此得出Cl2使有色物质褪色的机理是潮湿氯气中发生反应,生成物具有漂白性。
(1)A是氯气发生装置,药品为MnO2、浓盐酸,二者发生以下反应MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)D装置的硬质玻璃管内盛有炭粉,与带有水蒸气的氯气发生氧化还原反应2Cl2+2H2O+C![]() CO2+4HCl;答案为:2Cl2+2H2O+C
CO2+4HCl;答案为:2Cl2+2H2O+C![]() CO2+4HCl;
CO2+4HCl;
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是吸收Cl2和HCl气体,防止污染环境;答案为:吸收Cl2和HCl气体,防止污染环境;
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是储存多余的Cl2;答案为:储存多余的Cl2;
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其可能原因是①随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发;答案为:①随反应的进行盐酸变稀,与MnO2不反应 ②浓盐酸的挥发;
(6)①该同学实验后并没有得到预期的实验现象,主要是Cl2被碱石灰吸收;答案为:Cl2被碱石灰吸收;
②该同学在实验中使用干燥布条、潮湿布条,他预期的实验现象应为干燥有色布条不褪色,而湿润有色布条褪色,由此得出Cl2使有色物质褪色的机理是Cl2与水反应生成HClO,而HClO具有漂白性。答案为:干燥有色布条不褪色,而湿润有色布条褪色;Cl2与水反应生成HClO,而HClO具有漂白性。


科目:高中化学 来源: 题型:
【题目】某实验小组用石墨作电极进行如下实验,实验观察到:a、d处试纸变蓝;b处变红,并局部褪色;c处无明显变化。下列说法中错误的是
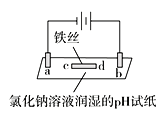
A. a极为阴极,发生的电极反应为2H++2e-=H2↑
B. b极为阳极,涉及的反应有2Cl--2e-=Cl2↑、Cl2+H2O![]() HCl+HClO
HCl+HClO
C. 电解过程中,a点电势低于c点电势,所以电子由a点移向c点
D. 若将铁丝改成铜丝,其余条件相同,电解一段时间后,能发现c处附近变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,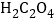 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
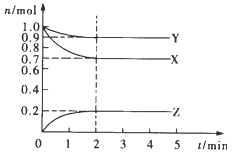
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气态物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为_________。反应开始至2 min,Z的平均反应速率为__________。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= -1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ/mol
则表示甲烷燃烧热的热化学方程式___________________________________________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式),生成该沉淀的离子方程式为__________________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)Na2S溶液具有较强的碱性,其原因为______________________。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃化合物A,最大质荷比为104,碳的质量分数为92.3%。
(1)A的分子式为___________,相对于氢气的密度为___________;其中核磁共振有____组峰,面积比为:___________;其中最少有________个原子共平面。
(2)A与溴的四氯化碳溶液反应的化学方程式为_______________________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________________;
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的结构简式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 用核磁共振氢谱能鉴别1-氯丙烷和2-氯丙烷
B. ![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
C. ![]() 和
和![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
D. 分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
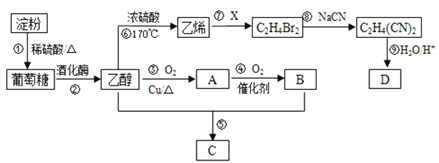
【题目】以淀粉为主要原料合成一种有果香味的物质C和化合物D的合成路线如下图所示。
已知:![]()
请回答下列问题:
(1)A的结构简式为____________________,B分子中的官能团名称为__________________。
(2)反应⑦的化学方程式为___________________________,反应⑧的类型为______________。
(3)反应⑤的化学方程式为_____________________________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
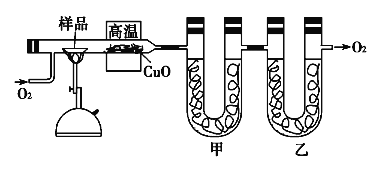
试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com