
【题目】芳香烃化合物A,最大质荷比为104,碳的质量分数为92.3%。
(1)A的分子式为___________,相对于氢气的密度为___________;其中核磁共振有____组峰,面积比为:___________;其中最少有________个原子共平面。
(2)A与溴的四氯化碳溶液反应的化学方程式为_______________________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________________;
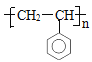
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的结构简式是_________。
【答案】C8H8 52 5 1∶1∶2∶2∶2 12 ![]()
![]()
![]()
【解析】
(1)化合物的最大质荷比是该物质的相对分子质量,然后根据元素的含量确定分子中各种元素的原子个数,得到分子式;相对密度是物质的相对分子质量是氢气相对分子质量的倍数;先根据分子式写出其结构简式,利用等效氢法,判断分子中H原子的种类数目,从而得到核磁共振氢谱的组数,面积比为H原子个数比;利用乙烯的平面结构及苯分子的平面结构进行判断;
(2)A的碳碳双键与溴发生加成反应;
(3)A中含有8个C原子,结合加成产物中C含量计算其相对分子质量及分子式,进而确定结构简式;
(4)A分子中含有碳碳双键,在一定条件下, A发生加聚反应得到高分子化合物;
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的分子中只含有一种H原子,可得B的结构简式。
(1)芳香烃化合物A,最大质荷比为104,则A相对分子质量是104,由于碳的质量分数为92.3%,则分子中含有的C原子个数为C:![]() =8,含有的H原子数为
=8,含有的H原子数为![]() =8,所以芳香烃A的分子式是C8H8;物质A的相对于氢气的密度为104÷2=52;由于A属于芳香族化合物,分子式为C8H8,则其结构简式为
=8,所以芳香烃A的分子式是C8H8;物质A的相对于氢气的密度为104÷2=52;由于A属于芳香族化合物,分子式为C8H8,则其结构简式为![]() ,该分子中含有5种H原子,它们的原子个数比为1∶1∶2∶2∶2,因此面积比为1∶1∶2∶2∶2;由于乙烯分子是平面分子,苯分子是平面六边形结构,苯环上处于对位的C原子在同一条直线上,由于单键可以旋转,所以共平面的原子至少有12个;
,该分子中含有5种H原子,它们的原子个数比为1∶1∶2∶2∶2,因此面积比为1∶1∶2∶2∶2;由于乙烯分子是平面分子,苯分子是平面六边形结构,苯环上处于对位的C原子在同一条直线上,由于单键可以旋转,所以共平面的原子至少有12个;
(2)苯乙烯分子中含有碳碳双键,可以与溴的四氯化碳溶液发生加成反应,而使溶液褪色,反应的方程式为:![]() ;
;
(3)A分子中含有8个C原子,与H发生加成反应时C原子数目不变,由于得到的化合物中碳的质量分数为85.7%,则加成产物的相对分子质量为(12×8)÷85.7%=112,则物质分子中含有的H原子数为H:112-12×8=16,因此A与氢气反应所得化合物的结构简式为![]() ;
;
(4)A是苯乙烯,分子中含有碳碳双键,在一定条件下, A发生加聚反应得到聚苯乙烯,该高分子化合物结构简式是: ;
;
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的分子中只含有一种H原子, B是立方烷,B的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】为排除![]() 、
、![]() 离子的干扰,在检验SO42-离子时,下列方法可行的是( )
离子的干扰,在检验SO42-离子时,下列方法可行的是( )
A.先加入BaCl2溶液,后再加入HNO3B.先加入HCl,后再加AgNO3溶液
C.先加入Ba(NO3)2溶液,后再加入HClD.先加入HCl,后再加入BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是
A.  提纯工业乙醇(含甲醇、水等杂质)
提纯工业乙醇(含甲醇、水等杂质)
B.  实验室中若需制备较多量的乙炔
实验室中若需制备较多量的乙炔
C. 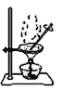 提纯含苯甲酸钠杂质的粗苯甲酸
提纯含苯甲酸钠杂质的粗苯甲酸
D.  检验溴乙烷与NaOH乙醇溶液加热制得的气体
检验溴乙烷与NaOH乙醇溶液加热制得的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a 和 b 不连接时,铁片上会有金属铜析出
B. 无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
C. a 和 b 分别连接直流电源正、负极,铜片上发生的反应为:Cu-2e-=Cu2+
D. a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
已知:K=![]()
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
(1) 37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
(2) 温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
(3) 研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=_________(注明速率常数单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置。

(1)A是氯气发生装置,其中发生反应的离子方程式为___。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为___。
(3)E装置这样设计的目的是防倒吸,除了防倒吸之外还有的作用是___。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是___。
(5)若实验中使用12mol· L-1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是___。
(6)某同学用如图的装置来验证氯气的有关性质:

①该同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因___。
②该同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是___,由此得出Cl2使有色物质褪色的机理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
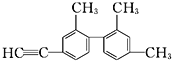
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_______;足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因________。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:___,两者气态氢化物的稳定性是:_______>_______(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______(文字简述)。
(4)写出步骤③中反应的离子方程式(说明:此反应在水溶液中进行):_______;
(5)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为NaBr、NaBrO3,同时放出CO2,请写出该反应的化学方程式并标明电子转移方向与数目:_______。
(6)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,如果反应前后元素的化合价发生变化,就一定有_______转移,这类反应就属于_________反应。元素化合价升高,表明该元素的原子_____电子,含该元素的物质发生________反应;例如在Fe2O3+3CO![]() 2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
2Fe+3CO2的化学反应中,_______是氧化剂,________是还原剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com