
【题目】为排除![]() 、
、![]() 离子的干扰,在检验SO42-离子时,下列方法可行的是( )
离子的干扰,在检验SO42-离子时,下列方法可行的是( )
A.先加入BaCl2溶液,后再加入HNO3B.先加入HCl,后再加AgNO3溶液
C.先加入Ba(NO3)2溶液,后再加入HClD.先加入HCl,后再加入BaCl2溶液
科目:高中化学 来源: 题型:
【题目】按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
① 2-甲基丁烷和丁烷________________, ②正戊烷和2,2-二甲基丙烷____________,③对二甲苯和1,4—二甲苯____________ , ④ 1-已烯和环已烷________________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。
① CH3CH2CH2COOH ② ![]() ③
③![]()
④ ![]() ⑤
⑤ ![]() ⑥
⑥ 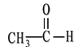
(1)芳香烃:__________;
(2)卤代烃:____________;
(3)酚:_______________;
(4)醛:______________;
(5)羧酸:______________;
(6)酯:_______________。
III.(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
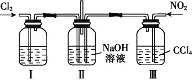
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
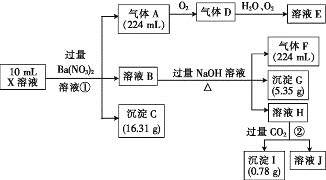
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO( g)+2H2(g)![]() CH3OH( g)△H1=-91kJ·mol-1
CH3OH( g)△H1=-91kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41kJ·mol-1
CO2(g)+H2(g)△H3=-41kJ·mol-1
回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g),该反应△H=______,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应④2CH3OH(g)![]()
![]() CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下,在1L密闭容器中加入CH3OH,反应10min时达到平衡,此时各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.01 | 0.2 | 0.2 |
①平衡常数表达式K=______,该温度的平衡常数为______。
②若加入CH3OH后,经10 min后达到平衡,该时间内的平均反应速率v(CH3OH)=________。
工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用石墨作电极进行如下实验,实验观察到:a、d处试纸变蓝;b处变红,并局部褪色;c处无明显变化。下列说法中错误的是
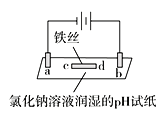
A. a极为阴极,发生的电极反应为2H++2e-=H2↑
B. b极为阳极,涉及的反应有2Cl--2e-=Cl2↑、Cl2+H2O![]() HCl+HClO
HCl+HClO
C. 电解过程中,a点电势低于c点电势,所以电子由a点移向c点
D. 若将铁丝改成铜丝,其余条件相同,电解一段时间后,能发现c处附近变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25mL 0.1mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
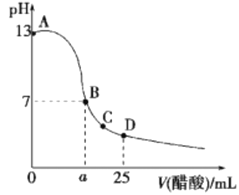
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. ![]()
C. C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH) =2c(H+) -c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,两个体积相同的玻璃密闭容器中分别盛满氮气和氧气,则容器中氮气和氧气的质量之比为___________________________。
(2)在标准状况下,11.2L某氮氧化物NOx气体的质量是23g,则x的值为___________________。
(3)200 mL Fe2(SO4)3溶液中含56g Fe3+,溶液中SO42—的物质的量浓度是___________________。
(4)一定质量的某金属元素R的硝酸盐受热完全分解,反应按下式进行:2R(NO3)2=2RO+4NO2↑+O2↑若得到1mol RO固体,则得到的气体在标准状况下的总体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃化合物A,最大质荷比为104,碳的质量分数为92.3%。
(1)A的分子式为___________,相对于氢气的密度为___________;其中核磁共振有____组峰,面积比为:___________;其中最少有________个原子共平面。
(2)A与溴的四氯化碳溶液反应的化学方程式为_______________________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________________;
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的结构简式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com